
【题目】向硫酸铜水溶液中逐滴滴加氨水,先生成蓝色沉淀,继续滴加氨水得到深蓝色溶液,再向溶液中加入乙醇,有深蓝色晶体[Cu(NH3)4]SO4·H2O析出。
(1)铜元素位于元素周期表中____区,高温超导体钇钡铜氧材料中铜元素有+2和+3两种价态,基态Cu3+的电子排布式为____。
(2)非金属元素N、O、S的第一电离能由大到小的顺序是____(用元素符号表示)。
(3)上述深蓝色晶体中含有的元素的电负性最小的是____(用元素符号表示)。
(4)H2O的中心原子轨道杂化类型为____杂化;SO42-离子的立体构型是____,写出与SO42-互为等电子体的一种离子____。
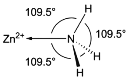
(5)NH3分子在独立存在时H-N-H键角为106.7°。如图为[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因____。
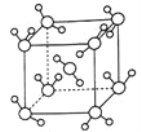
(6)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7pm,阿伏加德罗常数的值取6.02×1023,则重冰的密度为____g.cm-3(只列式,不计算)。
【答案】ds 1s22s22p63s23p63d8 N>O>S Cu sp3杂化 正四面体形 PO43-(或ClO4-) 氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与成键电子对间的排斥作用变为成键电子对间的排斥,排斥减弱,故H-N-H键角变大 ![]()
【解析】
(1)根据元素周期表,Cu位于周期表中第4周期第ⅠB族,位于ds区;
铜的核外电子排布式1s22s22p63s23p63d104s1,基态Cu3+失去最外层的三个电子,基态Cu3+的核外电子排布式1s22s22p63s23p63d8,
答案为:ds;1s22s22p63s23p63d8;
(2)N、O位于同一周期,同周期从左到右,第一电离能呈现增大的趋势,但N的最外层电子处于半充满状态,故第一电离能N>O,O、S位于同一主族,同主族从上到下,第一电离能呈减小的趋势,故第一电离能O>S,故第一电离能由大到小的顺序为N>O>S,
故答案为N>O>S;
(3)深蓝色晶体为[Cu(NH3)4]SO4·H2O,含有Cu、N、H、S、O元素,非金属性越弱,电负性越小,则电负性最小的为Cu,
答案为:Cu;
(4)H2O的中心原子是O,根据VSEPR理论,价电子对数为成键电子对+孤电子对数=2+![]() =4根据杂化轨道理论,中心原子O的杂化方式为sp3;深蓝色晶体的阴离子为SO42-,根据VSEPR理论,价电子对数为成键电子对+孤电子对数=4+
=4根据杂化轨道理论,中心原子O的杂化方式为sp3;深蓝色晶体的阴离子为SO42-,根据VSEPR理论,价电子对数为成键电子对+孤电子对数=4+![]() =4,根据杂化轨道理论,中心S的杂化方式为sp3,五个原子构成,则其空间构型为正四面体;等电子体是指在原子数相同下,原子的价电子数相同的粒子,通常采用元素上下左右平移法,同时调电子数来确定等电子体粒子;与SO42-互为等电子体的离子PO43-(或ClO4-)
=4,根据杂化轨道理论,中心S的杂化方式为sp3,五个原子构成,则其空间构型为正四面体;等电子体是指在原子数相同下,原子的价电子数相同的粒子,通常采用元素上下左右平移法,同时调电子数来确定等电子体粒子;与SO42-互为等电子体的离子PO43-(或ClO4-)
故答案为:sp3;正四面体;PO43-(或ClO4-);
(5)中心原子采取不同的杂化形式时,其等性杂化轨道的空间分布情况及杂化轨道之间的夹角是各不相同的。这是决定键角大小的最根本的原因。氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥减弱,故Zn2+键角变大。
故答案为:氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥减弱,故Zn2+键角变大。
(6)晶胞中水分子数目=1+8×![]() =2,晶胞质量=
=2,晶胞质量=![]() g,晶体密度ρ=
g,晶体密度ρ=![]()
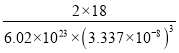 ,
,
答案为: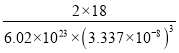 。
。


科目:高中化学 来源: 题型:
【题目】如图为实验室制取乙酸乙酯的装置。请回答:
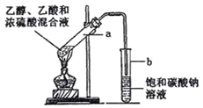
(1)检验该装置气密性的方法是___________________。
(2)浓硫酸的作用是__________。
(3)下列有关该实验的说法中,正确的是___________。
A.向a试管中加入沸石,作用是防止加热时液体暴沸
B.饱和碳酸钠溶液可以除去产物中混有的乙酸
C.乙酸乙酯是一种无色透明、密度比水大的油状液体
D.若原料为CH3COOH 和 CH3CH218OH,则乙酸乙酯中含有18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电能是现代社会应用最广泛的能源之一。
(1)某原电池装置如图所示。

其中,Zn电极为原电池的______极(填“正”或“负”),电极反应式是______。Cu电极上发生的反应属于______(填“氧化”或“还原”) 反应,当铜表面析出4.48 L氢气(标准状况)时,导线中通过了______ mol电子。
(2)下列反应通过原电池装置,可实现化学能直接转化为电能的是______(填序号)。
①CaO+H2O=Ca(OH)2
②2H2+O2 =2H2O
③2FeCl3+Cu=CuCl2+2FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验。

(1)装置A制取氯气,该反应的化学方程式:___________。
(2)装置C中发生复分解反应制取SO2,该反应的化学方程式:___________。
(3)为验证SO2和Cl2发生了反应,小组同学又继续如下实验。
①甲同学认为若SO2和Cl2反应,生成了Cl-,只要检验到生成的Cl-即可,甲取适量B中样品于试管中,向其中滴加少量___________溶液,有白色沉淀生成。
②乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法实验即可得到正确结论。洗气瓶中盛有试剂的名称是___________。
③丙同学认为按乙同学的建议改进实验也不合理,理由是:___________。
④丙同学取溶液X于试管中,加入少量反应后B中的溶液,生成大量白色沉淀,得出正确结论:SO2与Cl2同时通入水中,可以发生反应。溶液X是_________(填选项序号)。
a. BaCl2溶液 b. Ba(OH)2溶液 c. 氯水 d. 石蕊溶液
SO2与Cl2同时通入水中反应的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见有机物 A、B、C、D、E的相互转化关系如下图。已知D 是有香味且不易溶于水的油状液体,E的产量可以用来衡量一个国家的石油化工发展水平。
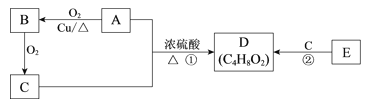
请回答:
(1)A中含有的官能团名称是___________。
(2)B的结构简式是___________。
(3)①的化学方程式是__________________。
(4)下列说法正确的是______。
a.E分子中所有原子在同一平面上
b.用饱和Na2CO3溶液除去D中混有的C
c.②的反应类型为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,纵坐标表示导电能力,横坐标表示所加溶液的量,以下各组反应符合该图的是( )

A.CH3COOH溶液中滴加KOH溶液
B.NaOH溶液中滴加稀HCl
C.Ba(OH)2溶液中滴加稀H2SO4
D.Cu(OH)2悬浊液中滴加HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如图。
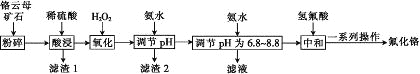
表中列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有________种。
(2)将铬云母矿石粉碎的目的是________。
(3)滤渣1主要成分的用途是________。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___________。
(5)第一次滴加氨水调节pH范围为________。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是_______,Cr(OH)3与 Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(p=1.84g·cm-3 )配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)配制时必需的玻璃仪器有:________________;
(2)在配置过程中,下列操作不正确的是(填序号)__________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解.
D.将准确量取的浓硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好.
(4)在配制过程中,①某学生观察定容时仰视液面,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”下同),②未经冷却趁热将溶液注入容量瓶中,_______,③容量瓶中原有少量蒸馏水,________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
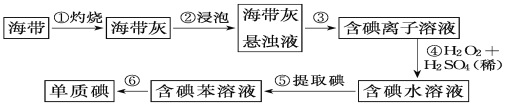
请填写下列空白:
(1)步骤①中灼烧海带时,除需要三脚架外,还需要用到的实验仪器是___;___;___;___。
(2)步骤③的实验操作名称是__;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是__。
(3)步骤④反应的离子方程式是___。
(4)步骤⑤中,某同学选择用苯来提取碘的理由是___。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com