
���� ��1����A�ǵؿ��к������Ľ���Ԫ�صļ����ӣ���AΪAl3+��BΪ��������ǿ����������ǿ��İ�ɫ��������Xǿ�BΪAl��OH��3��CΪƫ�����Σ�
��2����AΪ��ʹʪ��ĺ�ɫʯ����ֽ���������壬��AΪNH3����B��C���ڿ����γɹ⻯ѧ��������XΪO2��BΪNO��CΪNO2��
��3����AΪ�ռ���Һ��XΪ�����������壬��AΪNaOH��XΪCO2����BΪNa2CO3��CΪNaHCO3��
��� �⣺��1����A�ǵؿ��к������Ľ���Ԫ�صļ����ӣ���AΪAl3+��BΪ��������ǿ����������ǿ��İ�ɫ��������Xǿ�BΪAl��OH��3��CΪƫ�����Σ�
��B��Cת�������ӷ���ʽ��Al��OH��3+OH-=AlO2-+2H2O���ʴ�Ϊ��Al��OH��3+OH-=AlO2-+2H2O��
����AlԪ�ض�ת��Ϊ����������������������������������=0mol��78g/mol=78g��39g��˵�������������һΪ��������ȫ��ֻ����Al��OH��3��������һ�����Ϊ���������ܽ⣬������Al��OH��3������������NaAlO2��
n��Al��OH��3��=$\frac{39g}{78g/mol}$=0.5mol��
������㣬��Al3++3OH-�TAl��OH��3����֪��NaOH�����ʵ���Ϊ0.5mol��3=1.5mol��
�ڳ��������ܽ⣬������Al��OH��3������������NaAlO2����
Al3++3OH-�TAl��OH��3��
1mol 3mol 1mol
�ܽ����������Ϊ1mol-0.5mol=0.5mol
Al��OH��3+OH-�TAlO2-+2H2O
0.5mol 0.5mol
�����ĵļ�����ʵ���Ϊ3mol+0.5mol=3.5mol��
�ʴ�Ϊ��1.5��3.5��
��2����AΪ��ʹʪ��ĺ�ɫʯ����ֽ���������壬��AΪNH3����B��C���ڿ����γɹ⻯ѧ��������XΪO2��BΪNO��CΪNO2��
��ʵ������ȡNH3�Ļ�ѧ����ʽ��2NH4Cl+Ca ��OH��2 $\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
�ʴ�Ϊ��2NH4Cl+Ca ��OH��2 $\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
��A��Bת���Ļ�ѧ����ʽ��4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O��
�ʴ�Ϊ��4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O��
��3����AΪ�ռ���Һ��XΪ�����������壬��AΪNaOH��XΪCO2����BΪNa2CO3��CΪNaHCO3��
��A+C��B�����ӷ���ʽ��OH-+HCO3-=CO32-+H2O��
�ʴ�Ϊ��OH-+HCO3-=CO32-+H2O��
����Na2CO3+HCl=NaHCO3+NaCl����֪̼����ת��Ϊ̼����������HClΪ2mol��ʣ��1molHCL���õ�̼������Ϊ2mol����NaHCO3+HCl=NaCl+H2O+CO2������֪HCl���㣬������1mol������̼������������Ϊ1mol��22.4L/mol=22.4L��
�ʴ�Ϊ��22.4��
���� ���⿼��������ƶϣ��������ڿ�������Ŀ����Ҫѧ����������Ԫ�ػ��������ʣ�������ѧ����������Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO2��SO2��������ʯ��ˮ | B�� | CO2��CO����ͨ�������������� | ||
| C�� | Cl2��HCl��������̼������Һ | D�� | Fe��Al�����ռ���Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��ʵ�����ʵ����������ж���ȷ���ǣ�������
��ʵ�����ʵ����������ж���ȷ���ǣ�������| A�� | ʵ��������ɫ���� | B�� | ʵ�����Һ��ɫ��� | ||
| C�� | ʵ��ų��������� | D�� | ʵ������ȳ��ְ�ɫ���������ܽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ڵ���ƽ�� | B�� | ��������Ŀǰ�ߴ��ں��� | ||
| C�� | c��OH-��ǰ��С�ں��� | D�� | ���ڵ�����������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��pH��ֽ��˫��ˮ��pH | |
| B�� | ����ʽ�ζ�����ȡ20.00 mL����K2Cr2O7��Һ | |
| C�� | ��������ƽ��ȡ 5.85 g NaCl���� | |
| D�� | �ô�ĥ�ڲ��������Լ�ƿ����Na2CO3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���߶�Ϊs-s �� �� | B�� | ���߶�Ϊp-p �� �� | ||
| C�� | ǰ��Ϊp-p �� ��������Ϊs-p �� �� | D�� | ǰ��Ϊs-s �� ��������Ϊs-p �� �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ڢܢ� | C�� | �ڢ� | D�� | �ۢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
�� ������2��4����-4-�һ����飮
������2��4����-4-�һ����飮 ���Ĺ����ŵ�����Ϊ̼̼˫�����ǻ���
���Ĺ����ŵ�����Ϊ̼̼˫�����ǻ��� ��
�� �γ���Ԫ�����ķ�Ӧ
�γ���Ԫ�����ķ�Ӧ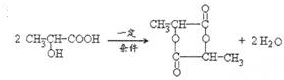 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ͷ������ͭ��Һ�У�2Na+Cu2+�T2Na++Cu | |
| B�� | AlCl3��Һ�м��������İ�ˮ��Al3++3OH-�TAl��OH��3�� | |
| C�� | �Ȼ�����Һ�м������ۣ�Fe3++Fe�T2Fe2+ | |
| D�� | ̼��������Һ�м�������������Һ��HCO3-+OH-�TCO32-+H2O |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com