
【题目】氧化还原反应的实质是( )
A.元素化合价发生变化B.反应中有氧原子的得失
C.反应中有电子转移D.反应后生成新物质
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是短周期的元素,它们的原子序数依次递增。A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,D与F同主族,G的原子半径是本周期元素中最小的。则:
(1)C元素的名称是__________ D元素的符号是____________
(2)B元素的最高价氧化物的电子式是_______________________
(3) G单质与E的最高价氧化物的水化物反应的离子方程式为____________.
(4)运送飞船的火箭燃料有一种液态化合物是由A、C元素组成的,已知该化合物的相对分子质量为32,其中氢元素的质量分数为12.5%,若该化合物与A2D2恰好完全反应,能产生两种无毒又不污染环境的物质,试写出该反应的化学方程式:______________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯醇(CH2=CH-CH2OH)是一种无色有刺激性气味的液体,是重要的有机合成原料.请回答:
(1)丙烯醇的分子式为_______________;丙烯醇中含有的官能团的名称是________.
(2)0. 3mol丙烯醇与足量金属钠反应,能生成标准状况下的氢气_________________ L.
(3)写出丙烯醇与溴水反应的化学方程式____________________反应类型为____________
(4)丙烯醇与CH3CO18OH发生酯化反应的化方程式为:________________________________________
(5)酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家首次合成的一种过渡金属的新核素![]() ,不易被腐蚀,可应用于高科技领域。185Hf可由180Hf转化而成,下列说法正确的是( )
,不易被腐蚀,可应用于高科技领域。185Hf可由180Hf转化而成,下列说法正确的是( )
A. 185Hf与180Hf质量数相同
B. 180Hf、185Hf在周期表中的位置不同
C. 1 mol 180Hf比1 mol 185Hf的中子数少5NA
D. 180Hf 和185Hf核外电子数分别为108、113
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,反应装置略去)。注:C中为氧化铜粉末。
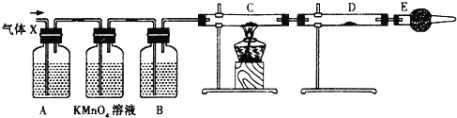
(1)实验室制备二氧化硫的化学方程式为:________________________________;
(2)乙同学认为产生氢气的理由是:______________________;
(3)B中试剂是______,D中试剂是______;(填名称)
(4)E装置的作用是_________________________;
(5)可以证明气体X中含有氢气的实验现象是:____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50 mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)甲同学设计实验的目的是验证:同一主族,从上到下金属元素的原子失电子能力逐渐增强;同一周期,从左到右金属元素的原子失电子能力逐渐___________________;
(2)反应最剧烈的烧杯中金属是_______(填字母序号);
A.钠 B.镁 C.铝 D.钾
(3)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法_________(填字母序号)。
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题
(1)实验装置:

(1)填写所示仪器名称:B__________
(2)实验步骤:
连接仪器、_____________、加药品后,打开 a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;装置E中酸性KMnO4溶液的作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是__________________;试管F中发生反应的离子方程式为_____________________。
③依据试管 D 中的反应,能否证明S的非金属性强于C的非金属性___(填 “能”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH﹣ , CO32﹣ , AlO2﹣ , SiO32﹣ , SO42﹣ , K + , Na + , Fe3 + , Mg2 + , Al3 + 等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是

A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32﹣与AlO2﹣的物质的量比为3:4
D.原溶液中一定含有的离子是OH﹣,CO32﹣,SiO32﹣,AlO2﹣,K +
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】升高温度能使反应速率加快,下列叙述正确的是( )
A. 降低反应所需的活化能
B. 对于吸热反应、放热反应,反应速率同等程度加大
C. 体系中活化分子总数不变
D. 使反应体系的活化分子百分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com