
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)其中V1=_____、T1=_____;通过实验_____(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=______。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_______。
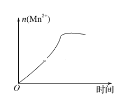
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是_______。
【答案】1 293 BC 3 其他条件相同,增大反应物浓度,反应速率增大 8.33×10-4mol/(Ls) 催化作用
【解析】
(1)探究外界条件对化学反应速率的影响实验时,两组实验中只有一个因素不同;
(2)若t1<8,对比实验A、B,温度相同,高锰酸钾的浓度相同,而草酸的浓度不同;
(3)根据图像中n(Mn2+)随时间的增大,迅速升高,进行解释。
(1)探究外界条件对化学反应速率的影响实验时,两组实验中只有一个因素不同,为不影响溶液混合导致浓度变化,则反应体系的总体相同,实验A,总体积为6mL,则V1=1mL,V2=3mL;实验B、C高锰酸钾及草酸的体积均相同,则探究温度不同时对反应速率的影响,还通过实验A、B对比试验探究浓度对化学反应速率的影响,则T1=293K;
(2)若t1<8,对比实验A、B,温度相同,高锰酸钾的浓度相同,而草酸的浓度不同,且A中浓度大于B的,则A的反应时间小于B,结论为:其他条件相同,增大反应物浓度,反应速率增大;v(KMnO4)=c/t=0.02×2/(6×8)=8.33×10-4mol/(Ls);
(3)根据图像中随时间的增大,n(Mn2+)迅速升高,表明生成的某粒子对该反应有催化作用,结合方程式,生成的产物为Mn2+,起催化作用。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用石墨电极电解MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=4NH4++AlO2-+2H2O
C.乙醛与新制Cu(OH)2悬浊液加热:CH3CHO+2Cu(OH)2+OH-![]() CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
D.向Ba(OH)2溶液中加入过量NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以NaClO3、H2SO4、SO2、H2O2和NaOH为原料,制备NaClO2和无水Na2SO4,其主要流程如下:

已知:① 2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O;
② 2ClO2+2NaOH=NaClO2+NaClO3+H2O;
③温度高于60 ℃时,NaClO2发生分解生成NaClO3和NaCl。
(1)反应1中SO2与NaClO3反应制得ClO2气体,该反应的化学方程式为________。
(2)在图1所示装置中发生反应2生成NaClO2,反应过程中放出大量的热。
①研究表明,实验时吸收液中H2O2与NaOH的物料比需要控制在0.8左右,原因可能是____________________________________________________。
②在吸收液中H2O2和NaOH的物料比、浓度和体积不变的条件下,控制反应在0~3 ℃进行,实验中可采取的措施是______________________。
③装置Ⅱ的作用是________________________。

(3) 母液2经过减压蒸发、冷却结晶等操作获得NaClO2粗产品。实验中采用减压蒸发的原因是________________________________________________。
(4) Na2SO4的溶解度曲线如图2所示。请补充完整由母液1制备无水Na2SO4的实验方案:______________________________________________________________,用无水乙醇洗涤,干燥得到产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度和容积不变的密闭容器中,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
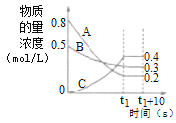
A.该反应的化学方程式为A(g)+3B(g)2C(g)
B.(t1+10)s时,升高温度,正、逆反应速率加快
C.在t1s时,V正(A)=0
D.若该反应在绝热容器中进行,也在t1时刻达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaCl固体配制100mL2.0mol·L1NaCl溶液,请回答下列问题。
(1)用到的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和__。
(2)用托盘天平称取NaCl固体的质量是__g。
(3)下列情况中,会使所配溶液浓度偏高的是__(填字母)。
A.定容时,俯视刻度线 B.转移液体时,有少量液体洒出
C.加蒸馏水超过了刻度线 D.没有洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氢氧燃料电池构造示意图。下列说法不正确的是( )

A. a极是负极
B. 电流由b通过灯泡流向a
C. 该电池总反应是2H2+ O2=2H2O
D. b极的电极反应为:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在探究Fe2+性质的实验中观察到异常现象。
实验Ⅰ | 现象 |
| 溶液变红,片刻红色褪去,有气体生成(经检验为O2)。 |
资料:ⅰ.Fe3++3SCN-=Fe(SCN)3(红色),Fe(SCN)3中S元素的化合价为2价
ⅱ.BaSO4是不溶于盐酸的白色沉淀
(1)实验Ⅰ体现了Fe2+的__性,补全H2O2与FeCl2酸性溶液反应的离子方程式:__Fe2+ +__H2O2+__H+ =__Fe3++__H2O
(2)探究“红色褪去”的原因,进行实验Ⅱ:将褪色后的溶液分三份分别进行实验。

实验Ⅱ得出的结论是:红色褪去的原因是__。
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ。
实验Ⅲ | 现象 |
| 溶液变红,一段时间后不褪色。 |
取上述反应后的溶液,滴加盐酸和BaCl2溶液 | 无白色沉淀产生。 |
分析上述三个实验,下列叙述正确的是__(填字母)。
A.实验Ⅲ中发生了氧化还原反应:4Fe2++O2+4H+=4Fe3++2H2O
B.通过实验Ⅲ推出实验Ⅰ中氧化FeCl2的只有O2
C.O2在该实验条件下不能使红色溶液褪色
D.实验Ⅰ中红色褪去与H2O2的氧化性有关
(4)上述实验探究过程用到的实验方法有__(写出一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫及其化合物的说法中正确的是( )
A.浓硫酸与灼热的炭反应,体现了浓硫酸的强氧化性和酸性
B.浓硫酸具有吸水性,可做干燥剂,不能干燥 NH3、 H2S等气体
C.SO2 和 Cl2 均可使品红溶液褪色,但将溶有 SO2 的品红溶液加热后又恢复红色,说明 SO2 的氧化性没有 Cl2 强
D.以 FeS和稀硫酸反应制H2S气体为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

A. 该反应的焓变ΔH>0
B. 图中Z的大小为a>3>b
C. 图中X点对应的平衡混合物中![]() =3
=3
D. 温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com