
【题目】下列指定反应的离子方程式正确的是( )
A.用石墨电极电解MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=4NH4++AlO2-+2H2O
C.乙醛与新制Cu(OH)2悬浊液加热:CH3CHO+2Cu(OH)2+OH-![]() CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
D.向Ba(OH)2溶液中加入过量NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
【答案】C
【解析】
A.电解氯化镁溶液时,阴极水电离出的氢离子放电生成氢气,同时产生氢氧根,氢氧根与镁离子结合会生成氢氧化镁沉淀,正确的例子方程式为2Cl-+2H2O+Mg2+![]() Mg(OH)2↓+H2↑+Cl2↑,故A错误;
Mg(OH)2↓+H2↑+Cl2↑,故A错误;
B.氨水为弱碱不能和氢氧化铝反应,正确离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+,故B错误;
C.乙醛与新制的Cu(OH)2悬浊液加热产生砖红色沉淀,离子反应为CH3CHO+2Cu(OH)2+OH-![]() CH3COO-+Cu2O↓+3H2O,故C正确;
CH3COO-+Cu2O↓+3H2O,故C正确;
D.向Ba(OH)2溶液中加入过量的NH4HSO4溶液,此时铵根不能反应,离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D错误;


科目:高中化学 来源: 题型:
【题目】在T℃条件下,向1L固定体积的密闭容器M中加入2molX和1molY,发生如下反应:2X(g)+Y(g)![]() a Z(g)+W(g) ΔH=-890kJ·mol-1(a为正整数)。
a Z(g)+W(g) ΔH=-890kJ·mol-1(a为正整数)。
当反应达到平衡后,反应放出的热量为Q1kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为_____。
(2)温度维持T ℃不变,若起始时向容器M中加入4molX和6molY,若达到平衡时容器内的压强减小了10%,则反应中放出的热量为___kJ。
(3)温度维持T ℃不变,若在一个和原容器体积相等的恒压容器N中,加入2molX和1 molY发生如上反应并达平衡,则容器中X的质量分数M___N(选填>、<、=符号)。
(4)已知:该反应的平衡常数随温度的变化如表:
温度/℃ | 200 | 250 | 300 | 350 |
平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
若在某温度下,2molX和1molY在容器M中反应达平衡, X的平衡转化率为50%,则该温度为_____℃。平衡时 X的体积分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH = - 49.0 kJmol-1。向3个恒容的密闭容器中分别投入物质的量比为 3∶4 的CO2和H2,H2的物质的量(mol)随时间(min)变化如下表(T表示温度),下列说法正确的是
CH3OH(g)+H2O(g) ΔH = - 49.0 kJmol-1。向3个恒容的密闭容器中分别投入物质的量比为 3∶4 的CO2和H2,H2的物质的量(mol)随时间(min)变化如下表(T表示温度),下列说法正确的是
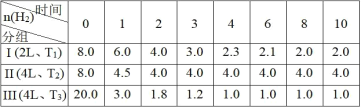
A.在第I组在0~8 min内CO2的平均反应速率为2 mol·L-1·min-1,且放出98 kJ热量
B.第I组第10 min后,恒温,再充入1 mol CO2(g)和3 mol H2O(g),则v 正<v 逆
C.3 min时,保持T2,若对第II组加压使体积缩小2 L,重新达平衡后各组分浓度与第I组相同
D.对比第I和第III组,在 0~4 min内,能说明H2的平均反应速率随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按系统命名法, ![]() 的名称是:______。
的名称是:______。
(2)石灰氮Ca(CN)2是离子化合物,其中CN-离子内部均满足各原子8电子稳定结构,写出Ca(CN) 2的电子式:______。
(3)氮的氢化物之一肼(N2H4)是一种油状液体,常做火箭燃料,与水任意比互溶,并且沸点高达113 ℃。肼的沸点高达113 ℃的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.澄清透明的溶液:K+、H+、SO42-、MnO4-
B.0.1 mol·L-1 NaClO溶液:Na+、NH4+、CO32-、SO32-
C.0.1 mol·L-1 FeCl3溶液:Ba2+、Al3+、SCN-、Cl-
D.![]() =0.1 mol·L-1的溶液:Na+、K+、AlO2-、Br-
=0.1 mol·L-1的溶液:Na+、K+、AlO2-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3与NaHCO3的性质判断正确的是( )
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N≡N、N—H、H—H的键能分别为946 kJ·mol-1、391 kJ·mol-1、436 kJ·mol-1。下列说法正确的是( )
A.N2与H2在一定条件下化合生成2 mol NH3时放出的热量为92 kJ
B.一定条件下合成氨反应N2+3H2![]() 2NH3达平衡时,3v(H2)正=2v(NH3)逆
2NH3达平衡时,3v(H2)正=2v(NH3)逆
C.用液氨和液氧制成的燃料电池放电时可实现将化学能全部转化为电能
D.反应NH3(g)+HCl(g)=NH4Cl(s)常温下能自发进行,该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图①②③④表示由不同化学元素组成的化合物,以下说法正确的是
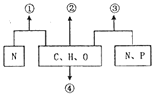
A. 若①为某生物大分子的组成单位,则①最可能是核苷酸
B. 若②是细胞中的储能物质,则②一定是脂肪
C. 若③是病毒的遗传物质,则③一定是RNA
D. 若④是植物细胞壁的主要成分,则④可能是纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)其中V1=_____、T1=_____;通过实验_____(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=______。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_______。
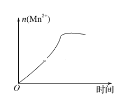
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com