
【题目】已知N≡N、N—H、H—H的键能分别为946 kJ·mol-1、391 kJ·mol-1、436 kJ·mol-1。下列说法正确的是( )
A.N2与H2在一定条件下化合生成2 mol NH3时放出的热量为92 kJ
B.一定条件下合成氨反应N2+3H2![]() 2NH3达平衡时,3v(H2)正=2v(NH3)逆
2NH3达平衡时,3v(H2)正=2v(NH3)逆
C.用液氨和液氧制成的燃料电池放电时可实现将化学能全部转化为电能
D.反应NH3(g)+HCl(g)=NH4Cl(s)常温下能自发进行,该反应的ΔH>0
【答案】A
【解析】
A.N2与H2在一定条件下化合生成氨气的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g)ΔH,焓变=反应物总键能-生成物总键能,所以ΔH=946 kJ·mol-1+436 kJ·mol-1×3-391 kJ·mol-1×6=-92 kJ·mol-1,焓变小于0为放热反应,所以N2与H2在一定条件下化合生成2 mol NH3时放出的热量为92 kJ,故A正确;
2NH3(g)ΔH,焓变=反应物总键能-生成物总键能,所以ΔH=946 kJ·mol-1+436 kJ·mol-1×3-391 kJ·mol-1×6=-92 kJ·mol-1,焓变小于0为放热反应,所以N2与H2在一定条件下化合生成2 mol NH3时放出的热量为92 kJ,故A正确;
B.该反应平衡时2v(H2)正=3v(NH3)正,又v(NH3)正= v(NH3)逆,所以2v(H2)正=3v(NH3)逆,故B错误;
C.用液氨和液氧制成的燃料电池放电时会有一部分能量以热能的形式散失,故C错误;
D.△H-T△S<0的反应可自发进行, NH3(g)+HCl(g)=NH4Cl(s)的△S<0,常温下能自发进行,则该反应的△H<0,故D错误;
故答案为A。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q均为短周期元素,其原子半径与主要化合价的关系如图所示。下列说法正确的是( )

A.X为锂元素
B.原子序数:M<Q
C.最高价含氧酸酸性:Z<M
D.Y、Z简单氢化物的沸点:Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用石墨电极电解MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=4NH4++AlO2-+2H2O
C.乙醛与新制Cu(OH)2悬浊液加热:CH3CHO+2Cu(OH)2+OH-![]() CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
D.向Ba(OH)2溶液中加入过量NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)过氧化钠与CO2反应的化学方程式:__;
(2)铁与水蒸气反应的化学方程式:__。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,配制完毕后要加入少量铁屑,其目的是___,向FeSO4溶液中滴加NaOH溶液,并放置一段时间,此过程中观察到的现象__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制取氯气并进行氯气性质实验的装置;装置中C、D均为洗气瓶,E瓶中有干燥的有色布条,F管中有铜丝,右端导管有脱脂棉,G瓶为集气瓶吸收装置。试回答:
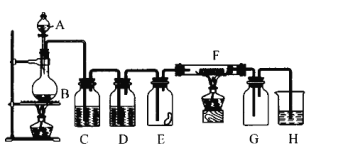
(1)C中试剂是___,作用是___,D中试剂是___,作用是___。
(2)E中的现象是___;F中的化学方程式为___,现象是___;脱脂棉的作用___。
(3)制取氯气的反应原理用化学方程式表示___。
(4)H中试剂是___,作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的是(夹持仪器未画出)
A.  用于检验溴乙烷消去生成的乙烯
用于检验溴乙烷消去生成的乙烯
B.  用于石油的分馏
用于石油的分馏
C.  用于实验室制硝基苯
用于实验室制硝基苯
D.  可证明酸性:盐酸>碳酸>苯酚
可证明酸性:盐酸>碳酸>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以NaClO3、H2SO4、SO2、H2O2和NaOH为原料,制备NaClO2和无水Na2SO4,其主要流程如下:

已知:① 2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O;
② 2ClO2+2NaOH=NaClO2+NaClO3+H2O;
③温度高于60 ℃时,NaClO2发生分解生成NaClO3和NaCl。
(1)反应1中SO2与NaClO3反应制得ClO2气体,该反应的化学方程式为________。
(2)在图1所示装置中发生反应2生成NaClO2,反应过程中放出大量的热。
①研究表明,实验时吸收液中H2O2与NaOH的物料比需要控制在0.8左右,原因可能是____________________________________________________。
②在吸收液中H2O2和NaOH的物料比、浓度和体积不变的条件下,控制反应在0~3 ℃进行,实验中可采取的措施是______________________。
③装置Ⅱ的作用是________________________。

(3) 母液2经过减压蒸发、冷却结晶等操作获得NaClO2粗产品。实验中采用减压蒸发的原因是________________________________________________。
(4) Na2SO4的溶解度曲线如图2所示。请补充完整由母液1制备无水Na2SO4的实验方案:______________________________________________________________,用无水乙醇洗涤,干燥得到产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在探究Fe2+性质的实验中观察到异常现象。
实验Ⅰ | 现象 |
| 溶液变红,片刻红色褪去,有气体生成(经检验为O2)。 |
资料:ⅰ.Fe3++3SCN-=Fe(SCN)3(红色),Fe(SCN)3中S元素的化合价为2价
ⅱ.BaSO4是不溶于盐酸的白色沉淀
(1)实验Ⅰ体现了Fe2+的__性,补全H2O2与FeCl2酸性溶液反应的离子方程式:__Fe2+ +__H2O2+__H+ =__Fe3++__H2O
(2)探究“红色褪去”的原因,进行实验Ⅱ:将褪色后的溶液分三份分别进行实验。

实验Ⅱ得出的结论是:红色褪去的原因是__。
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ。
实验Ⅲ | 现象 |
| 溶液变红,一段时间后不褪色。 |
取上述反应后的溶液,滴加盐酸和BaCl2溶液 | 无白色沉淀产生。 |
分析上述三个实验,下列叙述正确的是__(填字母)。
A.实验Ⅲ中发生了氧化还原反应:4Fe2++O2+4H+=4Fe3++2H2O
B.通过实验Ⅲ推出实验Ⅰ中氧化FeCl2的只有O2
C.O2在该实验条件下不能使红色溶液褪色
D.实验Ⅰ中红色褪去与H2O2的氧化性有关
(4)上述实验探究过程用到的实验方法有__(写出一条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com