
【题目】下列实验装置能达到实验目的是(夹持仪器未画出)
A.  用于检验溴乙烷消去生成的乙烯
用于检验溴乙烷消去生成的乙烯
B.  用于石油的分馏
用于石油的分馏
C.  用于实验室制硝基苯
用于实验室制硝基苯
D.  可证明酸性:盐酸>碳酸>苯酚
可证明酸性:盐酸>碳酸>苯酚
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是( )
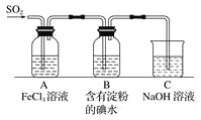
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.澄清透明的溶液:K+、H+、SO42-、MnO4-
B.0.1 mol·L-1 NaClO溶液:Na+、NH4+、CO32-、SO32-
C.0.1 mol·L-1 FeCl3溶液:Ba2+、Al3+、SCN-、Cl-
D.![]() =0.1 mol·L-1的溶液:Na+、K+、AlO2-、Br-
=0.1 mol·L-1的溶液:Na+、K+、AlO2-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N≡N、N—H、H—H的键能分别为946 kJ·mol-1、391 kJ·mol-1、436 kJ·mol-1。下列说法正确的是( )
A.N2与H2在一定条件下化合生成2 mol NH3时放出的热量为92 kJ
B.一定条件下合成氨反应N2+3H2![]() 2NH3达平衡时,3v(H2)正=2v(NH3)逆
2NH3达平衡时,3v(H2)正=2v(NH3)逆
C.用液氨和液氧制成的燃料电池放电时可实现将化学能全部转化为电能
D.反应NH3(g)+HCl(g)=NH4Cl(s)常温下能自发进行,该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向盛有KI3溶液的试管中加入适量CCl4,振荡后静置,CCl4层显紫色(已知I3- | KI3在CCl4中的溶解度比在水中的大 |
B | 向淀粉溶液中加入稀硫酸水浴加热后,再加入银氨溶液水浴加热,未出现银镜 | 淀粉未发生水解 |
C | 向饱和Na2CO3溶液中加入少量BaSO4粉末搅拌,过滤,向洗净的沉淀中加入稀盐酸,有气体放出 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 向新制饱和氯水中滴加紫色石蕊试液,溶液先变红后褪色 | 氯水具有酸性和漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图①②③④表示由不同化学元素组成的化合物,以下说法正确的是
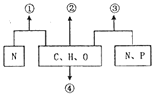
A. 若①为某生物大分子的组成单位,则①最可能是核苷酸
B. 若②是细胞中的储能物质,则②一定是脂肪
C. 若③是病毒的遗传物质,则③一定是RNA
D. 若④是植物细胞壁的主要成分,则④可能是纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸是一种重要的化工原料,熔点为133 ℃、沸点为300 ℃,不溶于冷水,易溶于有机溶剂,广泛应用于医药、感光树脂和食品添加剂。实验室用苯甲醛和乙酸酐[化学式为(CH3CO)2O,有吸湿性,溶于水形成乙酸]制备肉桂酸的反应原理如下:
![]() +(CH3CO)2O
+(CH3CO)2O![]()
![]() +CH3COOH
+CH3COOH
过程中发生的副反应如下:
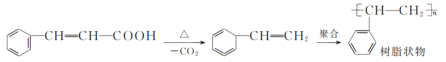
实验步骤如下:
步骤1:在三颈烧瓶中加入3 mL苯甲醛、8 mL乙酸酐和4.2 g K2CO3固体,搅拌,控制温度在150~170 ℃,加热回流45 min。
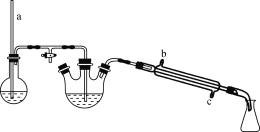
步骤2:向反应液中分批加入20 mL水,再加入Na2CO3固体调节溶液pH至8,然后进行水蒸气蒸馏。(装置如图)
步骤3:待三颈烧瓶中的剩余液体冷却后,加入活性炭,煮沸10~15 min,趁热过滤。
步骤4:将滤液冷却至室温,用盐酸酸化,待晶体析出完全后进行抽滤,用冷水洗涤晶体,干燥得到产品。
(1) 步骤1中,三颈烧瓶使用前必须干燥的原因是________;加入过量乙酸酐的目的是________。
(2) 步骤2中,水蒸气蒸馏时所用装置中玻璃管a的作用是________;冷凝管中冷凝水应从________(填“b”或“c”)口流入。
(3) 步骤3中,加入活性炭的目的是__________________________________。
(4) 步骤4中,抽滤所用的装置包括________、吸滤瓶和抽气泵。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。如图为联合制碱法的主要过程(部分物质已略去)。
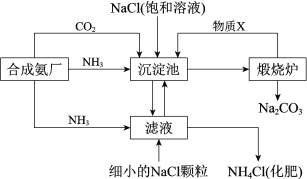
资料:ⅰ.沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
ⅱ.溶解度
物质 | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
20°C溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
(1)煅烧炉中反应的化学方程式是___,物质X是___(填化学式)。
(2)下列说法正确的是__(填字母)。
A.沉淀池中有NaHCO3析出,因为一定条件下NaHCO3的溶解度最小
B.滤液中主要含有NaCl、Na2CO3和NH4Cl
C.设计循环的目的是提高原料的利用率
(3)工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与Cl2反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是___。
(4)某纯碱样品中含杂质NaCl,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中Na2CO3的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列条件的溶液中,各组离子一定能够大量共存的是( )
A.使酚酞溶液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.无色透明溶液中:K+、SO42-、MnO4-、H+
C.含有大量OH-的溶液中:Ba2+、Na+、NO3-、Cl-
D.可与锌反应放出氢气的溶液中:Na+、Ca2+、Cl-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com