
����Ŀ����T�������£���1L�̶�������ܱ�����M�м���2molX��1molY���������·�Ӧ��2X(g)��Y(g)![]() a Z(g)��W(g) ��H����890kJ��mol��1(aΪ������)��
a Z(g)��W(g) ��H����890kJ��mol��1(a������)��
����Ӧ�ﵽƽ���Ӧ�ų�������ΪQ1kJ������X��ת����Ϊ������ƽ����������¶ȣ���������ƽ����Է���������С����
��1����ѧ������a��ֵΪ_____��
��2���¶�ά��T �治�䣬����ʼʱ������M�м���4molX��6molY�����ﵽƽ��ʱ�����ڵ�ѹǿ��С��10%����Ӧ�зų�������Ϊ___kJ��
��3���¶�ά��T �治�䣬����һ����ԭ���������ȵĺ�ѹ����N�У�����2molX��1 molY�������Ϸ�Ӧ����ƽ�⣬��������X����������M___N(ѡ�������������)��
��4����֪���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯�����
�¶�/�� | 200 | 250 | 300 | 350 |
ƽ�ⳣ��K | 9.94 | 5.2 | 1 | 0.5 |
����ij�¶��£�2molX��1molY������M�з�Ӧ��ƽ�⣬ X��ƽ��ת����Ϊ50%������¶�Ϊ_____�档ƽ��ʱ X���������Ϊ____��
���𰸡�1 890 �� 350 40%
��������
(1)������һ��������£�ƽ����Է�������������ķ������ɷ��ȡ�
(2)����ͬ���¶Ⱥ���ͬ����������£�ѹǿ֮�ȵ�����������ʵ���֮�ȡ�
(3)�÷�Ӧ���ص������������������С�����Ժ��º�ѹ�ͺ��º�����ȣ��൱�ڼ�ѹ��
(4)������¶��µ�ƽ�ⳣ�������ݱ�����ƽ�ⳣ�����¶ȵĹ�ϵ�жϣ�
��1���÷�Ӧ��һ��������ȵķ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ�����������ƽ����Է���������С��ƽ����Է��������ļ�С��˵����Ӧ�������������֮�ʹ���������ģ���3>a+1��a��Ϊ��������ֻ��Ϊ1��
��2��ͬһ�¶�ͬһ�����У�����ķ�����֮�������ʵ���֮�ȣ�����Ӧ�ﵽƽ��ʱ�����ڵ�ѹǿ������10%���������Ŀ������10%����������ʵ���Ҳ�ͼ���10%������������ʵ������٣�4 mol +6 mol����10%=1mol�����ݷ�Ӧʽ2X(g)��Y(g)![]() Z(g)��W(g)������������ʵ�������1molʱ���μӷ�Ӧ��X�����ʵ�����2mol����Ӧ�зų�������Ϊ890kJ��
Z(g)��W(g)������������ʵ�������1molʱ���μӷ�Ӧ��X�����ʵ�����2mol����Ӧ�зų�������Ϊ890kJ��
��3���÷�Ӧ��һ�����������������С�ķ�Ӧ������ͬ���¶�ʱ����ѹ�������ȣ��൱������ѹǿ������ѹǿ�÷�Ӧ��ƽ��������Ӧ�����ƶ�����X��������������С������������X����������M>N��
��4��2molX��1molY������M�з�Ӧ���ﵽƽ��ʱ��X��ת����Ϊ50%����ƽ��ʱ��
c(X)=(1-50%)��2mol��1L=1mol/L��
c(Y)=0.5c(X)=0.5mol/L��
c(Z)=c(W)=c(Y)=0.5mol/L��
����K=��0.5��0.5������0.5��12��=0.5���������¶���350����ƽ��ʱX���������Ϊ��
1mol/L����1+0.5+0.5+0.5��mol/L=40%��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
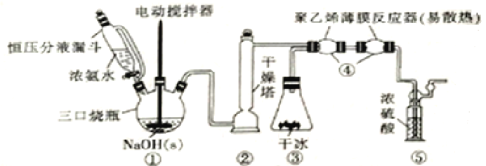
����Ŀ��H2NCOONH4(59��ʱ�������ֽ�)�����������м��弰ҽҩ�ȡ����ɸ����NH3��CO2�ڵ�����(���ˮԡ)��ȡ��װ����ͼ��ʾ��
�ش��������⣺
(1)װ�â���������ѹ��Һ©����������ͨ�ķ�Һ©�������ŵ���_____________������Ũ��ˮ�������ܲ�������NH3��ԭ����____________________��װ�âڸ�������ʢ�ŵĺ��ʸ������_____________(������)��
(2)װ�â���ʢ�ɱ�װ�ô���ʵ�����Ʊ�CO2�ij����Ʊ�������ת�ã����ŵ��װ�ü���ҿɲ������������CO2�⣬�����е��ŵ���____________________________________��
(3)װ�â���������ϩ��Ĥ��Ӧ�������淴Ӧ�ܵ��ŵ���____________��������ϩ��Ĥ��Ӧ�����з�����Ӧ�Ļ�ѧ����ʽΪ_____________________________________________��
(4)�ӻ��������Ƕȷ�����װ�âݵ�������_____________��������ͨ���۲�����ȷ��NH3��CO2�ı����Ƿ���ʣ��жϵ����ݼ�������ʱ�ĵ��ڷ���Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ������ˮ��Һ��ֻ���ܺ������������е������֣�K+��NH4+��Cl����Mg2+��Ba2+��CO32����SO42������ȡ���ݸ�100mL����Һ��������ʵ�飺
����һ�ݼ���AgNO3��Һ�г���������
���ڶ��ݼ�����NaOH��Һ���Ⱥ��ռ�������0.08mol��
�������ݼ�����BaCl2��Һ�ø������12.54g������������ϴ�ӡ������������Ϊ4.66g����������ʵ�飬�ش��������⣺
��1���ɵڶ��ݽ��е�ʵ���֪�������Ӧ����___________���ӣ������ʵ���Ũ��Ϊ________��
��2���ɵ����ݽ��е�ʵ���֪12.54�˳����ijɷ���______________��д������ѧʽ���������ʵ����ֱ�Ϊ______________________��
��3��ԭ��Һ���Ƿ����K+_______��ǡ�����������K+��Ũ�ȵ�ȡֵ��Χ��____________________���������ڴ˿տɲ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǹ�ҵ����ȡ�����һ�ַ�����

��ش���������(��Ԫ������Ӧ��Ԫ�ط��ű�ʾ)��
��1�����������������У������û���Ӧ����____(�Ӧ����)��
��2��д����Ӧ�۵Ļ�ѧ����ʽ____��
��3��������W����;�ܹ㣬ͨ��������������ҵ����ֽ��ҵ���ϼ�����������������������Ȼˮ������������ʯӢɰ�ʹ��һ��������ϼ�����1 373��1 623 K��Ӧ�����ɻ�����W���仯ѧ����ʽ��____��
��4��A��B��C���������������ܼ���������Ϊ����Ŀ���һ��������___(�ѧʽ)���ֱ�ͨ��W��Һ���ܵõ���ɫ������������___(�ѧʽ)��
��5����ҵ�Ϻϳɰ���ԭ��H2���Ʒ����Ȱѽ�̿��ˮ������Ӧ����ˮú�������ᴿˮú���õ�������H2���ᴿˮú���õ�������H2�Ļ�ѧ����ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������غ������Ļ����Һ�У���������ӵ�Ũ��Ϊ0.4mol��L-1������������0.4mol��L-1����������Һʱ�����ɵij���ǡ����ȫ�ܽ⡣��Ӧ����Һ�м����ӵ�Ũ��ԼΪ�� ��
A.0.225mol��L-1B.0.25mol��L-1C.0.45mol��L-1D.0.9mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����Ƶ�����ˮ�ⷴӦ��ͼ��ʾ���г�װ��ʡ�ԣ�������˵��������ǣ� ��
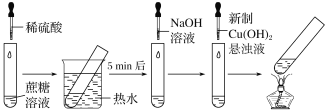
A.ϡ�������ˮԡ���ܼӿ�����ˮ������
B.�μ�NaOH��Һ��Ŀ���ǵ���Һ��pH������
C.���������ں��Թ������ɺ�ɫ����
D.ʵ������֤������ˮ���л�ԭ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��Q��Ϊ������Ԫ�أ���ԭ�Ӱ뾶����Ҫ���ϼ۵Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��

A.XΪ�Ԫ��
B.ԭ��������M<Q
C.��ۺ��������ԣ�Z<M
D.Y��Z���⻯��ķе㣺Y<Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪��TiO2(s)��2Cl2(g)=TiCl4(l)��O2(g)����H����140 kJ��mol��1����
2C(s)��O2(g)=2CO(g)����H����221 kJ��mol��1����
д��TiO2�ͽ�̿��������Ӧ����TiCl4��CO������Ȼ�ѧ����ʽ��_____________
��2����25�桢101kPa�£�һ����������ˮ�Ҵ���ȫȼ��ʱ�ų�����Q kJ����ȼ�����ɵ�CO2�ù�������ʯ��ˮ���տɵ�100g CaCO3���������Ҵ�ȼ�յ��Ȼ�ѧ����ʽΪ____________________________��
��3�����������о���Ա������ú��������Ȼ�ѧѭ��ʵ��̫���ܵ�ת����洢���������£�

��Ӧ����2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ��H1=+551 kJ��mol��1
2SO2(g)+2H2O(g)+O2(g) ��H1=+551 kJ��mol��1
��Ӧ����S(s)+O2(g)![]() SO2(g) ��H3=��297 kJ��mol��1
SO2(g) ��H3=��297 kJ��mol��1
��Ӧ�����Ȼ�ѧ����ʽ��______________________________________________��
��4��������H2SO4��Һ�м���100mL 0.4mol��L��1Ba(OH)2��Һ���ų���������5.12kJ�����������Ba(OH)2��Һ�м���100mL 0.4mol��L��1����ʱ���ų�������Ϊ2.2kJ����Na2SO4��Һ��BaCl2��Һ��Ӧ���Ȼ�ѧ����ʽΪ_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����(����)
A.��ʯī�缫���MgCl2��Һ��2Cl����2H2O![]() 2OH����H2����Cl2��
2OH����H2����Cl2��
B.��AlCl3��Һ�м��������ˮ��Al3����4NH3��H2O=4NH4+��AlO2-��2H2O
C.��ȩ������Cu(OH)2����Һ���ȣ�CH3CHO��2Cu(OH)2��OH��![]() CH3COO����Cu2O����3H2O
CH3COO����Cu2O����3H2O
D.��Ba(OH)2��Һ�м������NH4HSO4��Һ��Ba2����2OH����NH4+��H����SO42-=BaSO4����NH3��H2O��H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com