
【题目】某学习小组设计的蔗糖水解反应如图所示(夹持装置省略)。下列说法错误的是( )
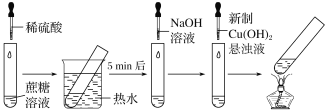
A.稀硫酸和热水浴都能加快蔗糖水解速率
B.滴加NaOH溶液的目的是调溶液的pH至碱性
C.加热至沸腾后试管内生成黑色沉淀
D.实验现象证明蔗糖水解有还原性物质生成
【答案】C
【解析】
A.稀硫酸是蔗糖水解反应的催化剂,催化剂能加快反应速率,热水浴相当于对反应体系加热,温度升高,反应速率加快,故A正确;
B.酸性条件下,新制的氢氧化铜悬浊液会与稀硫酸发生酸碱中和反应,影响后续蔗糖水解产物的检验,滴加NaOH溶液的目的是调溶液的pH至碱性,消除稀硫酸对后续实验现象的影响,故B正确;
C.蔗糖在稀硫酸存在、水浴加热时发生水解生成一分子葡糖糖和一分子果糖,葡萄糖分子结构中有醛基,具有还原性,与新制氢氧化铜发生氧化还原反应,加热至沸腾后试管内生成砖红色氧化亚铜沉淀,故C错误;
D.结合C项分析,以及实验现象,氢氧化铜转化为氧化亚铜,Cu元素化合价降低,被还原,证明蔗糖水解有还原性物质生成,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应:
2X(g)+Y(g)![]() 2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是:
2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是:
A. 将容器体积变为10L,Z的平衡浓度变为原来的![]()
B. 在该温度下,该反应的平衡常数K=0.011
C. 达到平衡时,容器内气体的压强是原来的90%
D. 若降低温度,X的体积分数增大,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源回收利用意义重大,镀锌废铁屑(表面附有锌皮、少量铁锈及油污)有很多用途,某工厂综合利用镀锌废铁屑的工艺如下图。请回答:

(1)用氢氧化钠溶液浸泡废铁屑的目的是_________。
(2)下列物质中最适合充当氧化剂A的是_______(填标号)。
A. KMnO4 B. Cl2 C.H2O2 D. HNO3
(3)聚合硫酸铁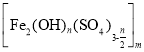 是水处理中重要的絮凝剂,聚合釜中主要发生“水解”和“聚合”两个过程,“水解”时反应的化学方程式为__。聚合釜中溶液的pH必须控制在一定的范围内,pH偏小Fe3+水解程度弱,pH偏大则__;相对于常压蒸发,减压蒸发的优点是__。
是水处理中重要的絮凝剂,聚合釜中主要发生“水解”和“聚合”两个过程,“水解”时反应的化学方程式为__。聚合釜中溶液的pH必须控制在一定的范围内,pH偏小Fe3+水解程度弱,pH偏大则__;相对于常压蒸发,减压蒸发的优点是__。
(4)纳米Fe3O4,可用于改善石墨烯材料的性能。制得溶液B时加入的氧化剂A需适量,原因是_____。
(5)废铁屑也能用来生产纳米铁粉,纳米铁粉能够去除地下水中的NO3-,反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O,研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是__。相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见下图),产生该差异的可能原因是___。
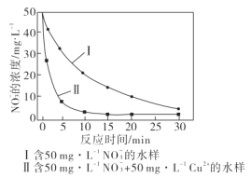
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将相同质量的镁条分别在①氧气、②空气、③氮气、④二氧化碳中完全燃烧,燃烧后所得固体产物的质量由小到大的顺序( )
A.③<②<①=④B.④=①=②=③
C.③<②<①<④D.③<①<②<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃条件下,向1L固定体积的密闭容器M中加入2molX和1molY,发生如下反应:2X(g)+Y(g)![]() a Z(g)+W(g) ΔH=-890kJ·mol-1(a为正整数)。
a Z(g)+W(g) ΔH=-890kJ·mol-1(a为正整数)。
当反应达到平衡后,反应放出的热量为Q1kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为_____。
(2)温度维持T ℃不变,若起始时向容器M中加入4molX和6molY,若达到平衡时容器内的压强减小了10%,则反应中放出的热量为___kJ。
(3)温度维持T ℃不变,若在一个和原容器体积相等的恒压容器N中,加入2molX和1 molY发生如上反应并达平衡,则容器中X的质量分数M___N(选填>、<、=符号)。
(4)已知:该反应的平衡常数随温度的变化如表:
温度/℃ | 200 | 250 | 300 | 350 |
平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
若在某温度下,2molX和1molY在容器M中反应达平衡, X的平衡转化率为50%,则该温度为_____℃。平衡时 X的体积分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示,下列说法错误的是
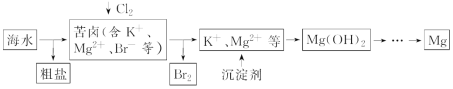
A.粗盐可采用除杂和重结晶等过程提纯
B.向苦卤中通入Cl2是为了提取溴
C.实际生产中常选用Ca(OH)2作为沉淀剂
D.工业生产中电解氯化镁溶液的方法制取镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)已知:
H2(g)+I2(g)=2HI(g) ΔH=QkJ·mol-1
H2(g)+I2(s)=2HI(g) ΔH=+26.48kJ·mol-1
I2(g)=I2(s) ΔH=-37.48kJ·mol-1
化学键 | I—I | H—I |
键能/(kJ·mol-1) | 151 | 299 |
键能是将1mol气体分子AB断裂为中性气态原子A和B所需要的能量,单位为kJ·mol-1。
①Q=____kJ·mol-1。
②H—H键能为____kJ·mol-1。
(2)716K时,在恒容密闭容器中按物质的量之比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如图:
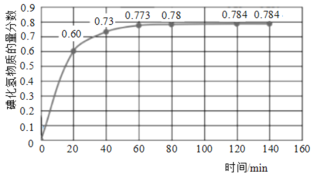
①若反应开始时气体混合物的总压为pkPa,则反应在前20min内的I2(g)平均速率![]() (I2)=___kPa·min-1(用含p的式子表示)。
(I2)=___kPa·min-1(用含p的式子表示)。
②在H2(g)+I2(g)![]() 2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,
2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,![]() =___(列出计算式)。
=___(列出计算式)。
③H2(g)+I2(g)![]() 2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是___。
2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是___。
(3)一定条件下,NaClO可将溶液中的I-氧化为I2。通过测定体系的吸光度,检测到不同pH下I2的生成量随时间的变化关系如图。
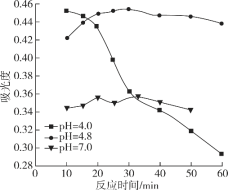
已知:吸光度越高表明该体系中c(I2)越大。
①pH=4.8时,在___min附近c(I2)最大。
②10min时,不同pH与吸光度的关系是___。
③pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3与NaHCO3的性质判断正确的是( )
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com