
【题目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH = - 49.0 kJmol-1。向3个恒容的密闭容器中分别投入物质的量比为 3∶4 的CO2和H2,H2的物质的量(mol)随时间(min)变化如下表(T表示温度),下列说法正确的是
CH3OH(g)+H2O(g) ΔH = - 49.0 kJmol-1。向3个恒容的密闭容器中分别投入物质的量比为 3∶4 的CO2和H2,H2的物质的量(mol)随时间(min)变化如下表(T表示温度),下列说法正确的是
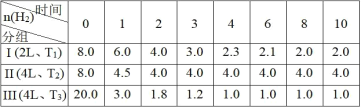
A.在第I组在0~8 min内CO2的平均反应速率为2 mol·L-1·min-1,且放出98 kJ热量
B.第I组第10 min后,恒温,再充入1 mol CO2(g)和3 mol H2O(g),则v 正<v 逆
C.3 min时,保持T2,若对第II组加压使体积缩小2 L,重新达平衡后各组分浓度与第I组相同
D.对比第I和第III组,在 0~4 min内,能说明H2的平均反应速率随温度升高而增大
【答案】B
【解析】
A.根据表格数据可知:在第I组在0~8 min内H2的物质的量改变6.0 mol,则CO2的物质的量变化2.0 mol,CO2平均反应速率v(CO2)=![]() =0.125 mol·L-1·min-1,A错误;
=0.125 mol·L-1·min-1,A错误;
B. 第I组第10 min后,恒温,再充入1 mol CO2(g)和3 mol H2O(g),由于生成物H2O(g)浓度增大的多于反应物CO2(g)浓度的增大,则反应速率v 正<v 逆,B正确;
C. 由于该反应的正反应是气体体积减小的反应,增大压强,化学平衡正向移动,3 min时,保持T2,若对第II组加压使体积缩小2 L,体系的压强增大,尽管物质的量及容器的容积与第I组相同,但由于温度T1、T2温度不同,所以最终重新达平衡后各组分浓度与第I组不相同,C错误;
D. 第I和第III组的物质浓度与反应温度都不相同,因此不能说明H2的平均反应速率随温度升高而增大,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL该溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到气体0.08mol;
③第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,回答下列问题:
(1)由第二份进行的实验得知混合物中应含有___________离子,其物质的量浓度为________。
(2)由第三份进行的实验可知12.54克沉淀的成分是______________(写沉淀化学式),其物质的量分别为______________________。
(3)原溶液中是否存在K+_______填“是”或“否)若存在则K+的浓度的取值范围是____________________(若不存在此空可不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q均为短周期元素,其原子半径与主要化合价的关系如图所示。下列说法正确的是( )

A.X为锂元素
B.原子序数:M<Q
C.最高价含氧酸酸性:Z<M
D.Y、Z简单氢化物的沸点:Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1 ①
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1 ②
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:_____________
(2)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100g CaCO3沉淀,则乙醇燃烧的热化学方程式为____________________________。
(3)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:______________________________________________。
(4)向足量H2SO4溶液中加入100mL 0.4mol·L-1Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4mol·L-1盐酸时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃、101.3 kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
A. 2∶1B. 1∶2C. 1∶7D. 7∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且 HClO的杀菌能力比ClO- 强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O![]() HClO+H++Cl- K2=10-3.4
HClO+H++Cl- K2=10-3.4
HClO![]() H++ClO- Ka=?
H++ClO- Ka=?
其中Cl2(aq)、HClO 和 ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是
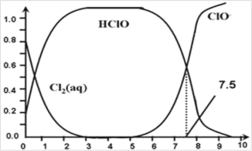
A.Cl2(g)+H2O![]() 2H++ClO-+Cl- K=10-10.9
2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用石墨电极电解MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=4NH4++AlO2-+2H2O
C.乙醛与新制Cu(OH)2悬浊液加热:CH3CHO+2Cu(OH)2+OH-![]() CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
D.向Ba(OH)2溶液中加入过量NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以NaClO3、H2SO4、SO2、H2O2和NaOH为原料,制备NaClO2和无水Na2SO4,其主要流程如下:

已知:① 2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O;
② 2ClO2+2NaOH=NaClO2+NaClO3+H2O;
③温度高于60 ℃时,NaClO2发生分解生成NaClO3和NaCl。
(1)反应1中SO2与NaClO3反应制得ClO2气体,该反应的化学方程式为________。
(2)在图1所示装置中发生反应2生成NaClO2,反应过程中放出大量的热。
①研究表明,实验时吸收液中H2O2与NaOH的物料比需要控制在0.8左右,原因可能是____________________________________________________。
②在吸收液中H2O2和NaOH的物料比、浓度和体积不变的条件下,控制反应在0~3 ℃进行,实验中可采取的措施是______________________。
③装置Ⅱ的作用是________________________。

(3) 母液2经过减压蒸发、冷却结晶等操作获得NaClO2粗产品。实验中采用减压蒸发的原因是________________________________________________。
(4) Na2SO4的溶解度曲线如图2所示。请补充完整由母液1制备无水Na2SO4的实验方案:______________________________________________________________,用无水乙醇洗涤,干燥得到产品。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com