
【题目】(1)按系统命名法, ![]() 的名称是:______。
的名称是:______。
(2)石灰氮Ca(CN)2是离子化合物,其中CN-离子内部均满足各原子8电子稳定结构,写出Ca(CN) 2的电子式:______。
(3)氮的氢化物之一肼(N2H4)是一种油状液体,常做火箭燃料,与水任意比互溶,并且沸点高达113 ℃。肼的沸点高达113 ℃的原因是______。
【答案】3,4-二甲基己烷 ![]() 分子间存在氢键
分子间存在氢键
【解析】
(1)根据烷烃的系统命名方法进行命名;
(2)根据C、N原子价电子数及CN-离子内部均满足各原子8电子稳定结构书写其电子式;
(3)根据肼分子内的化学键及分子间的氢键分析。
(1)选择分子中最长碳链为主链,在该物质分子中最长碳链上含有6个C原子,把支链当作取代基,给主链上C原子编号,以确定支链在主链碳原子上的位置,该物质名称为3,4-二甲基己烷;
(2)石灰氮Ca(CN)2是离子化合物,阳离子Ca2+与阴离子CN-之间通过离子键结合,在阴离子CN-离子内部C与N原子形成三对共用电子对,C原子再得到1个电子形成带一个单位负电荷的阴离子,从而使阴离子中每个原子满足各原子8电子稳定结构,则Ca(CN) 2的电子式为:![]() ;
;
(3)肼是由N2H4分子构成的分子晶体,在分子内含有4个N-H键和1个N-N键,由于N原子半径小,元素的非金属性强,使得在N2H4分子之间存在氢键,增加了分子之间的吸引力,导致物质的熔沸点较高。


科目:高中化学 来源: 题型:
【题目】以下是工业上制取纯硅的一种方法。

请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有____(填反应代号);
(2)写出反应③的化学方程式____;
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂。将石英砂和纯碱按一定比例混合加热至1 373~1 623 K反应,生成化合物W,其化学方程式是____;
(4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是___(填化学式);分别通入W溶液中能得到白色沉淀的气体是___(填化学式);
(5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1 ①
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1 ②
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:_____________
(2)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100g CaCO3沉淀,则乙醇燃烧的热化学方程式为____________________________。
(3)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:______________________________________________。
(4)向足量H2SO4溶液中加入100mL 0.4mol·L-1Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4mol·L-1盐酸时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且 HClO的杀菌能力比ClO- 强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O![]() HClO+H++Cl- K2=10-3.4
HClO+H++Cl- K2=10-3.4
HClO![]() H++ClO- Ka=?
H++ClO- Ka=?
其中Cl2(aq)、HClO 和 ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是
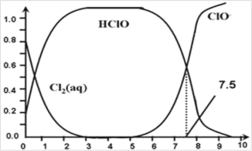
A.Cl2(g)+H2O![]() 2H++ClO-+Cl- K=10-10.9
2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞德西韦是一种核苷类似物,研究表明它对治疗新冠病毒具有一定的治疗效果, 其中 K 为合成瑞德西韦过程中重要的中间体,其制备方法如下图所示。请回答:

已知:①
②R-OH![]()
(1)下列说法正确的是_____________。
A.化合物D能发生加成、取代、氧化反应,不发生还原反应
B.化合物A能与FeCl3溶液发生显色反应
C.化合物 I 具有两性
D.K的分子式是C20H22N2PO7
(2)写出化合物C的结构简式______________。
(3)写出 F+J→K的化学方程式_____________。
(4)请以苯甲醇为原料合成 的流程_____________。
的流程_____________。
(5)X是C的同分异构体,写出满足下列条件的X的结构简式_____________
①苯环上含有硝基且苯环上只有一种氢原子;
②遇FeCl3溶液发生显色反应;
③1 mol X与足量金属Na反应可生成2 g H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用石墨电极电解MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=4NH4++AlO2-+2H2O
C.乙醛与新制Cu(OH)2悬浊液加热:CH3CHO+2Cu(OH)2+OH-![]() CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
D.向Ba(OH)2溶液中加入过量NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制取氯气并进行氯气性质实验的装置;装置中C、D均为洗气瓶,E瓶中有干燥的有色布条,F管中有铜丝,右端导管有脱脂棉,G瓶为集气瓶吸收装置。试回答:
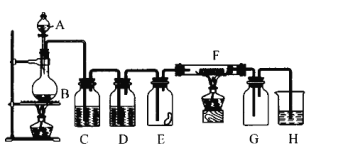
(1)C中试剂是___,作用是___,D中试剂是___,作用是___。
(2)E中的现象是___;F中的化学方程式为___,现象是___;脱脂棉的作用___。
(3)制取氯气的反应原理用化学方程式表示___。
(4)H中试剂是___,作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度和容积不变的密闭容器中,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
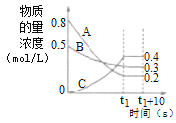
A.该反应的化学方程式为A(g)+3B(g)2C(g)
B.(t1+10)s时,升高温度,正、逆反应速率加快
C.在t1s时,V正(A)=0
D.若该反应在绝热容器中进行,也在t1时刻达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com