
【题目】瑞德西韦是一种核苷类似物,研究表明它对治疗新冠病毒具有一定的治疗效果, 其中 K 为合成瑞德西韦过程中重要的中间体,其制备方法如下图所示。请回答:

已知:①
②R-OH![]()
(1)下列说法正确的是_____________。
A.化合物D能发生加成、取代、氧化反应,不发生还原反应
B.化合物A能与FeCl3溶液发生显色反应
C.化合物 I 具有两性
D.K的分子式是C20H22N2PO7
(2)写出化合物C的结构简式______________。
(3)写出 F+J→K的化学方程式_____________。
(4)请以苯甲醇为原料合成 的流程_____________。
的流程_____________。
(5)X是C的同分异构体,写出满足下列条件的X的结构简式_____________
①苯环上含有硝基且苯环上只有一种氢原子;
②遇FeCl3溶液发生显色反应;
③1 mol X与足量金属Na反应可生成2 g H2。
【答案】BC 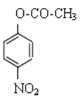
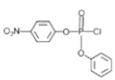 +
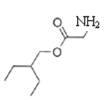
+
![]()
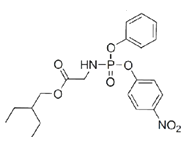 +HCl
+HCl 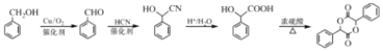
 、
、
【解析】
物质反应过程在碳链结构不变,由D逆推可知分子式是C6H6O的物质A结构简式为:![]() ,A能够与CH3COCl发生取代反应产生B:
,A能够与CH3COCl发生取代反应产生B:![]() ,B与浓硝酸、浓硫酸混合加热发生对位上的取代反应产生C:
,B与浓硝酸、浓硫酸混合加热发生对位上的取代反应产生C: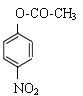 ,C再发生取代反应产生D:
,C再发生取代反应产生D: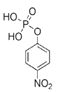 ,D与SOCl2在加热时发生羟基的取代反应产生E:
,D与SOCl2在加热时发生羟基的取代反应产生E: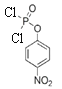 ,E和A发生取代反应生成F:
,E和A发生取代反应生成F: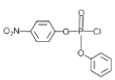 ,G发生信息①的反应生成H,H发生取代反应、水解反应得到I:
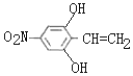
,G发生信息①的反应生成H,H发生取代反应、水解反应得到I:![]() ,根据I结构简式知H为HOCH2CN,G为HCHO,I与
,根据I结构简式知H为HOCH2CN,G为HCHO,I与![]() 发生酯化反应生成J:
发生酯化反应生成J: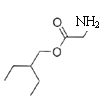 ,F与J发生取代反应生成K,结合题目分析解答。
,F与J发生取代反应生成K,结合题目分析解答。
根据上述分析可知A是![]() ,B是
,B是![]() ,C是
,C是 ,D是
,D是 ,E是
,E是 ,F是
,F是 ,G是HCHO,H为HOCH2CN, I是
,G是HCHO,H为HOCH2CN, I是![]() ;J是
;J是 。
。
(1)A. 化合物D结构简式是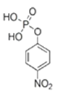 ,含有苯环,能发生加成、取代,物质能够燃烧,可发生氧化反应,含有-NO2,能够发生还原反应变为-NH2,A错误;
,含有苯环,能发生加成、取代,物质能够燃烧,可发生氧化反应,含有-NO2,能够发生还原反应变为-NH2,A错误;
B. 化合物A是苯酚,含有酚羟基,能与FeCl3溶液发生显色反应,B正确;
C.化合物 I是氨基酸,含有氨基、羧基,所以具有两性,C正确;
D.根据K结构简式可知物质K的分子式是C20H23N2PO7,D错误;
故合理选项是BC;
(2)根据上述分析可知化合物C的结构简式为: ;
;
(3) F是 ,J是
,J是 ,F与J发生取代反应K,该反应的化学方程式为:
,F与J发生取代反应K,该反应的化学方程式为: +
+
![]()
 +HCl;
+HCl;
(4)以苯甲醇为原料制备化合物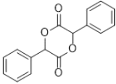 ,
,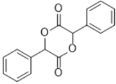 可由
可由![]() 发生酯化反应得到,
发生酯化反应得到,![]() 可由
可由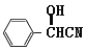 水解得到,苯甲醛和HCN发生加成反应得到
水解得到,苯甲醛和HCN发生加成反应得到 ,苯甲醇发生氧化反应生成苯甲醛,其合成路线为:
,苯甲醇发生氧化反应生成苯甲醛,其合成路线为: ;
;
(5)C是对硝基乙酸苯酯,X是C同分异构体,X的结构简式满足下列条件:
①苯环上含有硝基且苯环上只有一种氢原子;
②遇FeCl溶液发生显色反应,说明含有酚羟基;
③1 mol的X与足量金属Na反应可生成2 g H2,生成1 mol H2,则说明分子在含有两个羟基,
根据不饱和度可知:分子在还存在-CH=CH2,该分子结构对称,
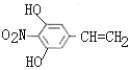
符合条件的结构简式为 、
、 。
。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】将相同质量的镁条分别在①氧气、②空气、③氮气、④二氧化碳中完全燃烧,燃烧后所得固体产物的质量由小到大的顺序( )
A.③<②<①=④B.④=①=②=③
C.③<②<①<④D.③<①<②<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一定体积的密闭容器中,下列叙述不能作为可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡状态标志的是 ( )
2C(g)达到平衡状态标志的是 ( )
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1∶3∶2
A. ②⑧B. ④⑦C. ①③D. ⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按系统命名法, ![]() 的名称是:______。
的名称是:______。
(2)石灰氮Ca(CN)2是离子化合物,其中CN-离子内部均满足各原子8电子稳定结构,写出Ca(CN) 2的电子式:______。
(3)氮的氢化物之一肼(N2H4)是一种油状液体,常做火箭燃料,与水任意比互溶,并且沸点高达113 ℃。肼的沸点高达113 ℃的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能锂离子电池总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法正确的是
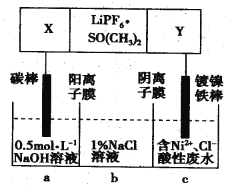
A. LiPF6·SO(CH3)2可用Li2SO4水溶液代替
B. 当转移1mol e-时,b室离子数增加NA个
C. 该电池充电时阳极反应式为Fe+Li2S-2e-=FeS+2Li+
D. 若去除图阴离子膜,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3与NaHCO3的性质判断正确的是( )
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同质量的镁和铝分别与足量盐酸反应产生的氢气体积比是___;相同体积的镁和铝分别与足量盐酸反应产生的氢气较多的是___;相同物质的量的镁和铝分别与足量盐酸反应产生的氢气体积比是___。(镁的密度:1.738g/cm3,铝的密度:2.70g/cm3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼铁的原理为:Fe2O3 +3CO![]() 2Fe+ 3CO2。
2Fe+ 3CO2。
(1)该反应中氧化剂是__(填化学式),碳元素被__(填“氧化”或“还原”)。
(2)若消耗了3molCO,则生成CO2的体积是__L(标准状况),转移电子的物质的量是___mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com