
����Ŀ���(40Zr)���ִ���ҵ����Ҫ����ԭ�ϣ��������õĿ����ԣ���ʴ���ܳ����ѡ����Ӣʯ(��Ҫ�ɷ���ZrSiO4������������A12O3��SiO2��Fe2O3������)Ϊԭ������ﯼ��仯�����������ͼ��ʾ��

��1��SiCl4�ĵ���ʽΪ__________�����������У������������ڶ����Ӧ���������Ƿ�Ӧ�е���ʧ��������õ���SiCl4����ͨ�����ɴ�ZrSiO4�����ķ�Ӧ�õ���SiCl4������ԭ����___________________________________________________��
��2������������Ĺ��������C�⣬�����еĽ���Ԫ����________
��3��д������������ZrCl4��ˮ��Ӧ�Ļ�ѧ����ʽ��_____________________��
��4��ﯻ��Ǻ˷�Ӧ��ȼ�ϰ��İ������ϣ�ﯺϽ��ڸ�������ˮ������Ӧ����������������ﯿ����������������մɡ����й���ﯡ�������ﯵ������У���ȷ����_____(�����)��
a��ﯺϽ�ȴ�ﯵ��۵�ߣ�Ӳ��С
b����������մ������������ǽ�������
c����һ������ͨ������������ﯻ����һ��������ͨ·
d���ɲ��ú�����Ӧ�Ѱ�����ȼ�ϵ�ﯺϽ����ȴ��
��5����ҵ�ϵ��K2ZrF6��KCl����ɵ�����Ҳ����ȡ����ﯡ�д�������ܷ�Ӧ����ʽ������
����ת�Ƶķ������Ŀ _________________________________________________��
��6��ijȼ�ϵ������C2H4��Ϊȼ��������һ��ͨ��������������Dz���������(Y2O3)�������(ZrO2)���壬������״̬���ܴ���O2�������Ϸ����ķ�ӦʽΪ_____________________��
��7����ϡ��Һ�����ʵ����ʵ���Ũ�Ⱥ�С�������为����pc��ʾ��pcB=��lgcB������ij��Һ�����ʵ����ʵ���Ũ��Ϊ1��10��5mol��L��1�������Һ�����ʵ�pc=5������˵����ȷ����_____
A���������Һ��pc��H+����pc��OH����֮�;�Ϊ14
B��������ζ�ijŨ�ȵ�KOH��Һ���ζ�������pc��H+��������
C��BaCl2��Һ����μ���������Һ���μӹ�����pc��Ba2+����С
D��ij�¶���Ksp��Zr(CO3)2��=4.0��10��12�����䱥����Һ��pc��Zr4+��+ pc��CO32����=7.7
���𰸡�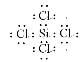 ��Ϊ�����е�SiO2Ҳͨ����Ӧ������SiCl4Al��FeZrCl4��9H2O===ZrOCl2��8H2O��2HClbdK2ZrF6��4KCl
��Ϊ�����е�SiO2Ҳͨ����Ӧ������SiCl4Al��FeZrCl4��9H2O===ZrOCl2��8H2O��2HClbdK2ZrF6��4KCl![]() Zr��6KF��2Cl2��C2H4��6O2����12e��==2CO2��2H2OBD
Zr��6KF��2Cl2��C2H4��6O2����12e��==2CO2��2H2OBD
��������
�Ӣʯ����Ҫ�ɷ�ΪZrSiO4��Ҳ�ɱ�ʾΪZrO2SiO2����������Al2O3��SiO2��Fe2O3�����ʣ���ͨ�������������Լ���������ʯ���ͷ�Ӧ��ZrSiO4ת��ΪZrCl4����ˮˮ�⣬ʹZrCl4ת��ΪZrOCl28H2O��900����ȷֽ⣬���ɵõ�ZrO2������þ�û��õ�����ﯣ�����þ�û��õ����������1��SiCl4�����й�ԭ���������4�����ӣ����γ�4�����ۼ��ﵽ�ȶ��ṹ��ÿ����ԭ�����γ�һ�����ۼ��ﵽ�ȶ��ṹ�������ڻ��������������ϼ۴�����Ϊ�㣬���ZrSiO4�Ļ�ѧʽ���н�����Ӣʯ��������SiO2��SiO2Ҳ���ڸ������������·�Ӧ����SiCl4����2�����ݸ������������ʵ�״̬�����ж�����3������ͼʾZrCl4��ˮ��Ӧ����ΪZrOCl28H2O�����ԭ���غ���н�𣻣�4���Ͻ���ָ��һ�ֽ���������������ǽ����ۺ϶��ɵľ��н������Ե����ʣ��Ͻ��Ӳ�ȴ��۵�ͣ��մ��������ǽ������ϣ��������Ϊ�����������ЧӦ����Ϊϡ�����壬��������������5�����K2ZrF6��KCl����ɵ����壬��Ӧ��ΪK2ZrF6��KCl��������Ϊ����ﯣ�ﯵĻ��ϼ۽��ͣ����ȵĻ��ϼ�������������������ԭ���غ㼴��ʧ�����غ��𣻣�6��ȼ�����ڼ�Ϊ����������ʧȥ���ӷ���������Ӧ��Ϊ��ϩʧ���Ӻ������ӷ�Ӧ���ɶ�����̼��ˮ��
�Ӣʯ����Ҫ�ɷ�ΪZrSiO4��Ҳ�ɱ�ʾΪZrO2SiO2����������Al2O3��SiO2��Fe2O3�����ʣ���ͨ�������������Լ���������ʯ���ͷ�Ӧ��ZrSiO4ת��ΪZrCl4����ˮˮ�⣬ʹZrCl4ת��ΪZrOCl28H2O��900����ȷֽ⣬���ɵõ�ZrO2������þ�û��õ�����ﯣ�����þ�û��õ����������1��SiCl4�����й�ԭ���������4�����ӣ����γ�4�����ۼ��ﵽ�ȶ��ṹ��ÿ����ԭ�����γ�һ�����ۼ��ﵽ�ȶ��ṹ������ʽΪ��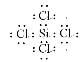 �������ڻ��������������ϼ۴�����Ϊ�㣬��Ԫ����-2�ۣ���Ԫ����+4�ۣ����Ԫ�أ�Zr���Ļ��ϼ���x����֪ZrSiO4���Ԫ�أ�Zr���Ļ��ϼۣ�x+��+4��+��-2����4=0����x=+4���Ӣʯ����Ҫ�ɷ�ΪZrSiO4��Ҳ�ɱ�ʾΪZrO2SiO2����������Al2O3��SiO2��Fe2O3�����ʣ�������SiO2Ҳ���ڸ������������·�Ӧ����SiCl4��������õ���SiCl4����ͨ�����ɴ�ZrSiO4�����ķ�Ӧ�õ���SiCl4������2������������Ĺ��������C�⣬�����������������������������еĽ���Ԫ����Al��Fe����3��ZrCl4��ˮ��Ӧ����ΪZrOCl28H2O������ԭ���غ㣬��Ӧ����ʽΪ��ZrCl4+9H2O�TZrOCl28H2O+2HCl����4��a���Ͻ���ָ��һ�ֽ���������������ǽ����ۺ϶��ɵľ��н������ԵĻ���һ��˵���Ͻ��Ӳ��һ��ȸ��ɷֽ��������Ͻ���۵� ����������ijɷֽ������۵㣬����ﯺϽ�ȴ�ﯵ��۵�ͣ�Ӳ�ȴ�a����b���մ��������ǽ������ϣ���������մ������������ǽ������ϣ���b��ȷ��c����һ������ͨ����������һ��������ͨ·�����������Ϊ�����������ЧӦ����c����d����Ϊϡ�����壬�ɲ��ú�����Ӧ�Ѱ�����ȼ�ϵ�ﯺϽ����ȴ������d��ȷ���ʴ�Ϊ��bd����5�����K2ZrF6��KCl����ɵ����壬��Ӧ��ΪK2ZrF6��KCl��������Ϊ����ﯣ�ﯵĻ��ϼ۽��ͣ�+4��0�������ȵĻ��ϼ���������������-1��0����ת��4e-������ԭ���غ㼴��ʧ�����غ����Է���ʽΪ��K2ZrF6+4KCl
�������ڻ��������������ϼ۴�����Ϊ�㣬��Ԫ����-2�ۣ���Ԫ����+4�ۣ����Ԫ�أ�Zr���Ļ��ϼ���x����֪ZrSiO4���Ԫ�أ�Zr���Ļ��ϼۣ�x+��+4��+��-2����4=0����x=+4���Ӣʯ����Ҫ�ɷ�ΪZrSiO4��Ҳ�ɱ�ʾΪZrO2SiO2����������Al2O3��SiO2��Fe2O3�����ʣ�������SiO2Ҳ���ڸ������������·�Ӧ����SiCl4��������õ���SiCl4����ͨ�����ɴ�ZrSiO4�����ķ�Ӧ�õ���SiCl4������2������������Ĺ��������C�⣬�����������������������������еĽ���Ԫ����Al��Fe����3��ZrCl4��ˮ��Ӧ����ΪZrOCl28H2O������ԭ���غ㣬��Ӧ����ʽΪ��ZrCl4+9H2O�TZrOCl28H2O+2HCl����4��a���Ͻ���ָ��һ�ֽ���������������ǽ����ۺ϶��ɵľ��н������ԵĻ���һ��˵���Ͻ��Ӳ��һ��ȸ��ɷֽ��������Ͻ���۵� ����������ijɷֽ������۵㣬����ﯺϽ�ȴ�ﯵ��۵�ͣ�Ӳ�ȴ�a����b���մ��������ǽ������ϣ���������մ������������ǽ������ϣ���b��ȷ��c����һ������ͨ����������һ��������ͨ·�����������Ϊ�����������ЧӦ����c����d����Ϊϡ�����壬�ɲ��ú�����Ӧ�Ѱ�����ȼ�ϵ�ﯺϽ����ȴ������d��ȷ���ʴ�Ϊ��bd����5�����K2ZrF6��KCl����ɵ����壬��Ӧ��ΪK2ZrF6��KCl��������Ϊ����ﯣ�ﯵĻ��ϼ۽��ͣ�+4��0�������ȵĻ��ϼ���������������-1��0����ת��4e-������ԭ���غ㼴��ʧ�����غ����Է���ʽΪ��K2ZrF6+4KCl ![]() Zr+6KF+2Cl2������6����ȼ�ϵ����ͨ����ϩ��һ��Ϊ����������������Ӧ����ϩʧ���Ӻ������ӷ�Ӧ���ɶ�����̼��ˮ���缫��ӦʽΪ��C2H4+6O2--12e-�T2CO2+2H2O����7��A����Һ�е�c��H+����c��OH������ˮ�ĵ���̶��йأ���ˮ�ĵ���̶����¶ȵ����߶������糣����Kw= c��H+��c��OH����=1.0��10-14����pc��H+��+pc��OH����=14������100��ʱ��Kw= c��H+��c��OH����=1.0��10-12����pc��H+��+pc��OH����=12��ѡ��A����B��������ζ�ijŨ�ȵ�KOH��Һ���ζ�������c��OH������С����c��H+������������pc��H+������С�ģ�ѡ��B��ȷ��C����BaCl2��Һ����μ���������Һ���μӹ�����c��Ba2+����С����pc��Ba2+��������ѡ��C����D��ij�¶���Ksp��Zr(CO3)2��=4.0��10��12�����䱥����Һ��c��Zr4+��=1��10��5mol��L��1��c��CO32����=2��10��5mol��L��1��pc��Zr4+��+ pc��CO32����=7.7��ѡ��D��ȷ����ѡBD��
Zr+6KF+2Cl2������6����ȼ�ϵ����ͨ����ϩ��һ��Ϊ����������������Ӧ����ϩʧ���Ӻ������ӷ�Ӧ���ɶ�����̼��ˮ���缫��ӦʽΪ��C2H4+6O2--12e-�T2CO2+2H2O����7��A����Һ�е�c��H+����c��OH������ˮ�ĵ���̶��йأ���ˮ�ĵ���̶����¶ȵ����߶������糣����Kw= c��H+��c��OH����=1.0��10-14����pc��H+��+pc��OH����=14������100��ʱ��Kw= c��H+��c��OH����=1.0��10-12����pc��H+��+pc��OH����=12��ѡ��A����B��������ζ�ijŨ�ȵ�KOH��Һ���ζ�������c��OH������С����c��H+������������pc��H+������С�ģ�ѡ��B��ȷ��C����BaCl2��Һ����μ���������Һ���μӹ�����c��Ba2+����С����pc��Ba2+��������ѡ��C����D��ij�¶���Ksp��Zr(CO3)2��=4.0��10��12�����䱥����Һ��c��Zr4+��=1��10��5mol��L��1��c��CO32����=2��10��5mol��L��1��pc��Zr4+��+ pc��CO32����=7.7��ѡ��D��ȷ����ѡBD��


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���������ʣ����������ڳ���ʯ��ˮ����ˮ������ϡ���ᣬ���Ȼ�ͭ���壬�������������ƣ������ǣ����ƾ�����������̼�������ᱵ���������ڵ���ʵ���______������ţ�������ͬ�������ڷǵ���ʵ���_________���ܵ������_________��
��2��д������������ȷֽ��������Ļ�ѧ��Ӧ����ʽ____________________����Ӧ�е���������________����ԭ������____________������2mol����ת��ʱ�����ɵ������ڱ�״���µ������________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���һ���������ܱ������г���2 mol SO2��1 mol O2��������Ӧ��2SO2(g)��O2(g)![]() 2SO3(g)����H��0���ﵽƽ��״̬����t1ʱ�̸ı���������ѧ��Ӧ������ʱ��仯��ϵ��ͼ��ʾ�����ж�t1ʱ�̸ı��������ƶ���ȷ����( )
2SO3(g)����H��0���ﵽƽ��״̬����t1ʱ�̸ı���������ѧ��Ӧ������ʱ��仯��ϵ��ͼ��ʾ�����ж�t1ʱ�̸ı��������ƶ���ȷ����( )
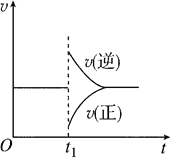
A. ����ѹǿ���䣬���߷�Ӧ�¶�
B. �����¶Ȳ��䣬�����������
C. �����¶Ⱥ�����������䣬����1 mol SO3(g)
D. �����¶Ⱥ�ѹǿ���䣬����1 mol SO3(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ȼ�ѧ����ʽ��˵����ȷ����
A. H2��ȼ����Ϊ285.8 kJ��mol1�����ʾH2ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��H2(g)+ ![]() O2
O2![]() H2O(g) ��H=285.8 kJ��mol1
H2O(g) ��H=285.8 kJ��mol1
B. �к���Ϊ57.3 kJ��mol1����NaOH����ᷴӦ���к��ȿ��Ա�ʾ���£�NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ��H=57.3 kJ��mol1
CH3COONa(aq)+H2O(l) ��H=57.3 kJ��mol1
C. ��֪��C(s�����ʯ)+O2(g)![]() CO2(g) ��H=395.4 kJ��mol1��C(s��ʯī)+O2(g)
CO2(g) ��H=395.4 kJ��mol1��C(s��ʯī)+O2(g)![]() CO2(g) ��H=393.5 kJ��mol1����C(s�����ʯ)
CO2(g) ��H=393.5 kJ��mol1����C(s�����ʯ)![]() C(s��ʯī)��H=1.9 kJ��mol1
C(s��ʯī)��H=1.9 kJ��mol1
D. ��֪1 mol CH4��ȫȼ������CO2��Һ̬ˮ�ų�890.4 kJ����������÷�Ӧ��ת��1 mol����ʱ�ų�������Ϊ222.6 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����ø�����ؼ��ȷֽⷨ��ȡ������ij��ȤС�龭�������ϻ�֪���Ƶ����������������е������(K2MnO4)����ǿ�����ԣ��뻹ԭ�����л����ȼ���Ͽ��γɱ�ը�Ի����粻���ƴ��ý����Σ�ա���˸�С��Ըò�������з����ᴿ���õ�����ؾ��壬���û��յ��������Ũ���ᷴӦ��ȡ�����������ʵ����֤������ѧ���ʡ�

��1���������װ�������Եķ�����:______________________________��
��2����Һ©�����������ɼ�2���۲쵽��ƿ�����Ϻ�ɫ�������ɲ�����ʧ������ɫ���������ƿ����Ӧ��������ƿ���к�ɫ������࣬д�������з����Ļ�ѧ��Ӧ����ʽ��_________________________________________��
��3���÷�����ȡ�������ô����ĸ������Ҫ����ƽ�����࣬�Է���ԭ��________��
��4����С������װ��C���������Ʊ�Ư�ۡ�
��C��ʢװ���Լ�Ϊ��________________________________����д���ƣ�
���մɶ�����ݵ������ǣ�_________________________________________________��
��5���ⶨƯ����Ч�ɷֵ�������������ȡ1.5g����Ư�������Һ������pHֵ������ָʾ������0.1000mol/L KI��Һ���еζ�������ƽ��ʵ��ƽ��ÿ������20.00mL��Һʱ�ﵽ�ζ��յ㡣��֪�����ԣ�ClO��> IO3��> I2
����ѡ��ָʾ��Ϊ��______________������ζ��յ�ı�־�ǣ�______________________��
�ڸ�Ư������Ч�ɷֵ���������Ϊ��__________________________��
��6����Һ©�����������ɼ�1���ɹ۲쵽D�е�����Ϊ��______________���������ܹ�֤�������������ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������H2RO4=H++HRO4-��HRO4-![]() H++RO42-,�������ʵ���Ũ�ȶ�Ϊ0.1mol/L��������Һ:��NaHRO4��Һ; ��H2RO4��Һ; ��Na2RO4��Һ������˵����ȷ����
H++RO42-,�������ʵ���Ũ�ȶ�Ϊ0.1mol/L��������Һ:��NaHRO4��Һ; ��H2RO4��Һ; ��Na2RO4��Һ������˵����ȷ����
A. �ں͢۵������Ϻ����Һ��: c( Na+)= c( HRO4-)+c(H2RO4) +c(RO42-)
B. 100mL����Һ��: n(HRO4-)+n(RO42-)+n(OH-)-n(H+)= 0.01
C. �ٺ͢ڵ������Ϻ����Һ�п��ܵ�����Ũ��Ϊc( HRO4-)>c(H+)>c(Na+)
D. ���ٺ͢۵������Ϻ�����ˮ�ĵ��룬��HRO4-�ĵ���̶ȿ϶�����RO42-��ˮ��̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ���� ( )
A. �����������ڿ����еı仯��2Fe(OH)2+O2+H2O=2Fe(OH)3
B. ����������Һ�мӹ���������Һ��Fe2+ + 2H2O2 + 4H+��Fe3+ + 4H2O
C. ��������������ᷴӦ��Fe(OH)3��3HI��FeI3+3H2O
D. ��������Һ�мӹ�����ˮ��Fe3+ + 3NH3��H2O��Fe(OH)3 + 3NH![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������µ��ܱ������У�NO(g) + CO(g)![]() 1/2N2(g) + CO2(g)����H = -373.2 kJ/mol���ﵽƽ���Ϊ��߷�Ӧ���ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ�� �� ��
1/2N2(g) + CO2(g)����H = -373.2 kJ/mol���ﵽƽ���Ϊ��߷�Ӧ���ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ�� �� ��
A. �Ӵ���ͬʱ�����¶� B. �Ӵ���ͬʱ����ѹǿ
C. �����¶�ͬʱ����N2 D. �����¶�ͬʱ����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����У�ͬʱ�����Ӽ������Թ��ۼ��ͷǼ��Թ��ۼ����Ѻ��γɵķ�Ӧ��
A. NH4Cl![]() NH3����HCl�� B. 2Na2O2��2CO2===2Na2CO3��O2
NH3����HCl�� B. 2Na2O2��2CO2===2Na2CO3��O2
C. 2NaOH��Cl2===NaCl��NaClO��H2O D. CaC2��H2O===Ca(OH)2+C2H2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com