
【题目】将一定量的H2、CO和CO2的混合气体通入盛有足量Na2O2粉末(Na2O2体积忽略不计)的密闭容器中,用电火花引燃直至反应完全。恢复到原温度,容器内的压强为原来的1/4,则原混合气体的平均相对分子质量可能是
A.20B.23C.30D.36
【答案】C
【解析】
将一定量的H2、CO和CO2的混合气体通入盛有足量Na2O2粉末,发生反应:2Na2O2+2CO2 =2Na2CO3+ O2,产生的O2在电火花作用下与原混合气体中的H2、CO发生燃烧反应:2H2+O2![]() 2H2O;2CO+O2
2H2O;2CO+O2![]() 2CO2;燃烧产物再与Na2O2反应:2Na2O2+2CO2 =2Na2CO3+ O2,2Na2O2+2H2O=4NaOH+ O2↑,叠加得到总方程式Na2O2+CO2 =Na2CO3,Na2O2+ H2O=2NaOH。固体增加的质量即是原混合气体中H2、CO的质量。可见最后剩余的气体只能是O2。对于气体来说,当容器的容积不变时,气体的物质的量的比就是容器内气体的压强之比。由于恢复到原温度,容器内的压强为原来的1/4,则n(气体)(前)=4 n(气体)(后).假设反应产生O2的物质的量是1mol,则原混合气体是4mol,根据方程式2Na2O2+2CO2 =2Na2CO3+ O2气体关系可知n(CO2)=2mol,n(CO)+n(H2)=2mol。若气体是H2与CO2的混合物,则气体的平均相对分子质量是(44+2)÷2=23;若气体是CO与CO2的混合物,则气体的平均相对分子质量是(44+28)÷2=36。由于是三者的混合物,所以气体的平均相对分子质量在23与36之间,符合要求的只有30,故选项是C。
2CO2;燃烧产物再与Na2O2反应:2Na2O2+2CO2 =2Na2CO3+ O2,2Na2O2+2H2O=4NaOH+ O2↑,叠加得到总方程式Na2O2+CO2 =Na2CO3,Na2O2+ H2O=2NaOH。固体增加的质量即是原混合气体中H2、CO的质量。可见最后剩余的气体只能是O2。对于气体来说,当容器的容积不变时,气体的物质的量的比就是容器内气体的压强之比。由于恢复到原温度,容器内的压强为原来的1/4,则n(气体)(前)=4 n(气体)(后).假设反应产生O2的物质的量是1mol,则原混合气体是4mol,根据方程式2Na2O2+2CO2 =2Na2CO3+ O2气体关系可知n(CO2)=2mol,n(CO)+n(H2)=2mol。若气体是H2与CO2的混合物,则气体的平均相对分子质量是(44+2)÷2=23;若气体是CO与CO2的混合物,则气体的平均相对分子质量是(44+28)÷2=36。由于是三者的混合物,所以气体的平均相对分子质量在23与36之间,符合要求的只有30,故选项是C。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O | K1=1.75×10-5mol·L-1 |
CH3COO-+H2O | K2=5.71×10-10mol·L-1 |
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)=CO2(g) △H1 C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+![]() O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A. c(OH-)/c(NH3·H2O) B. n(OH-)
C. c(NH3·H2O)/c(OH-) D. c(H﹢)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是合成芳香族有机高聚物P的合成路线。
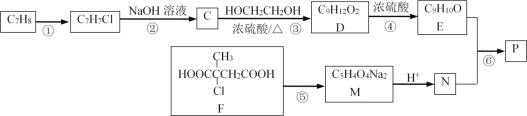
已知:ROH+ R’OH![]() ROR’ + H2O
ROR’ + H2O
完成下列填空:
(1)F中官能团的名称_____________________;写出反应①的反应条件______;
(2)写出反应⑤的化学方程式______________________________________________。
(3)写出高聚物P的结构简式__________。
(4)E有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式______。
①分子中只有苯环一个环状结构,且苯环上有两个取代基;
②1mol该有机物与溴水反应时消耗4molBr2
(5)写出以分子式为C5H8的烃为主要原料,制备F的合成路线流程图(无机试剂任选)。合成路线流程图示例如:![]() ____________________
____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中不正确的是( )
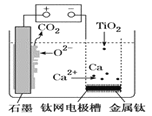
A.由TiO2制得1mol金属Ti,理论上外电路转移4mol电子
B.阳极的电极反应式为2O2--4e-=O2↑
C.在制备金属钛前后,整套装置中CaO的总量会不断减少
D.装置中石墨电极材料需要定期更换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现甲、乙两化学小组安装两套如图所示的相同装置,用以探究影响H2O2分解速率的因素。

(1)仪器a的名称___。
(2)MnO2催化下H2O2分解的化学方程式是___。
(3)甲小组有如下实验设计方案,请帮助他们完成表格中未填部分。
实验编号 | 实验目的 | T/K | 催化剂 | 浓度 |
甲组实验Ⅰ | 作实验参照 | 298 | 3滴FeCl3溶液 | 10mL2%H2O2 |
甲组实验Ⅱ | ①__ | 298 | ②__ | 10mL5%H2O2 |
(4)甲、乙两小组得出如图数据。
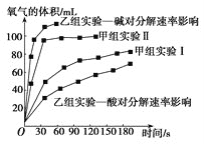
①由甲组实验数据可得出文字结论__。
②由乙组研究的酸、碱对H2O2分解影响因素的数据相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是__;乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2,其化学反应方程式为_;支持这一方案的理由是_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二钴主要用作颜料、釉料及磁性材料,利用铜钴矿石制备Co2O3的工艺流程如图所示。
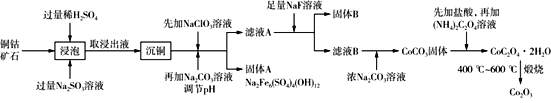
已知:铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。请回答下列问题:
(1)“浸泡”过程中可以加快反应速率和提高原料利用率的方法是_______(写出2种即可)。
(2)“浸泡”过程中,加入Na2SO3溶液的主要作用是____________。
(3)向“沉铜”后的滤液中加入NaClO3溶液,写出滤液中的金属离子与NaClO3反应的离子方程式________________。
(4)温度、pH对铜、钴浸出率的影响如图1、图2所示:
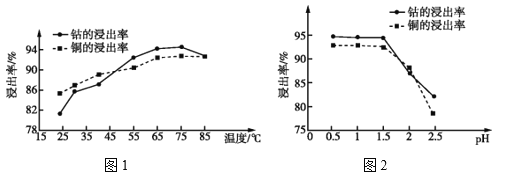
①“浸泡”铜钴矿石的适宜条件为__________________。
②图2中pH增大时铜、钴浸出率下降的原因可能是___________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是________。
(6)一定温度下,向滤液A中加入足量的NaF溶液可将Ca2+、Mg2+沉淀而除去,若所得滤液B中c(Mg2+)=1.0×10-5 mol/L,则滤液B中c(Ca2+)为______。[已知该温度下Ksp(CaF2)=3.4×10-11,Ksp(MgF2)=7.1×10-11]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验甲醛含量的方法有很多,其中银﹣Ferrozine法灵敏度较高。测定原理为甲醛把氧化银还原成Ag,产生的Ag与Fe3+定量反应生成Fe2+,Fe2+与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如下装置测定新装修居室内空气中甲醛的含量(夹持装置略去)。

已知:甲醛能被银氨溶液氧化生成CO2,氮化镁与水反应放出NH3,毛细管内径不超过1 mm。请回答下列问题:
(1)A装置中反应的化学方程式为___________,用饱和食盐水代替水制备NH3的原因是___________________。
(2)B中装有AgNO3溶液,仪器B的名称为________。
(3)银氨溶液的制备。关闭K1、K2,打开K3,打开______,使饱和食盐水慢慢滴入圆底烧瓶中,当观察到B中白色沉淀恰好完全溶解时,________。
(4)室内空气中甲醛含量的测定。
①用热水浴加热B,打开K1,将滑动隔板慢慢由最右端抽到最左端,吸入1 L室内空气,关闭K1;后续操作是______________;再重复上述操作3次。毛细管的作用是__________。
②向上述B中充分反应后的溶液中加入稀硫酸调节溶液pH=1,再加入足量Fe2(SO4)3溶液,充分反应后立即加入菲洛嗪,Fe2+与菲洛嗪形成有色物质,在562 nm处测定吸光度,测得生成Fe2+1.12 mg,空气中甲醛的含量为____mg·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com