
����Ŀ���ּס�������ѧС�鰲װ������ͼ��ʾ����ͬװ�ã�����̽��Ӱ��H2O2�ֽ����ʵ����ء�

��1������a������___��
��2��MnO2����H2O2�ֽ�Ļ�ѧ����ʽ��___��
��3����С��������ʵ����Ʒ����������������ɱ�����δ��֡�
ʵ���� | ʵ��Ŀ�� | T/K | ���� | Ũ�� |
����ʵ��� | ��ʵ����� | 298 | 3��FeCl3��Һ | 10mL2%H2O2 |
����ʵ��� | ��__ | 298 | ��__ | 10mL5%H2O2 |
��4���ס�����С��ó���ͼ���ݡ�
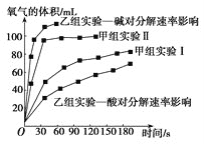
���ɼ���ʵ�����ݿɵó����ֽ���__��
���������о����ᡢ���H2O2�ֽ�Ӱ�����ص�������ͬ�����£�Na2O2��K2O2����ˮ�ų��������ʽϿ����__���������������BaO2������H2SO4��Һ��Ӧ��H2O2���仯ѧ��Ӧ����ʽΪ_��֧����һ������������_��
���𰸡���ƿ 2H2O2![]() 2H2O+O2�� ̽����Ӧ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� 3��FeCl3��Һ ��������������ʱ����Ӧ��Ũ��Խ��Ӧ����Խ�� K2O2 Ba2O2+H2SO4=BaSO4+H2O2 �Ʊ�H2O2�Ļ���Ϊ���Ի�����H2O2�ķֽ����ʽ���
2H2O+O2�� ̽����Ӧ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� 3��FeCl3��Һ ��������������ʱ����Ӧ��Ũ��Խ��Ӧ����Խ�� K2O2 Ba2O2+H2SO4=BaSO4+H2O2 �Ʊ�H2O2�Ļ���Ϊ���Ի�����H2O2�ķֽ����ʽ���
��������
�Ÿ���ͼʾ����a�ó����ơ�
��H2O2��MnO2�������·ֽ�����O2��H2O��
�Ƿ�Ӧ�������¶ȡ�Ũ�ȡ�������Ӱ�죬����ʵ������ʵ�������¶���ͬ��Ũ�Ȳ�ͬ����˸�ʵ�����̽������Ũ�ȶԷ�Ӧ���ʵ�Ӱ�졣
�����ɼ���ʵ�����ݿɵã�����ʵ�������÷�Ӧ��Ũ�Ƚϴ���ͬʱ���ڲ�������������ϴ�
��������ʵ�����ݿ�֪�����������£�H2O2�ķֽ����ʸ��죬����KOH�ļ��Ա�NaOH�ļ���ǿ�����K2O2��H2O��Ӧ�ų���������ʽϿ죻�÷�Ӧ�Ļ�ѧ����ʽΪ��BaO2+H2SO4 = BaSO4+H2O2�����ڸ÷�Ӧ�����������½��У������������£�H2O2�ķֽ����ʽ�����
��ͼʾ����aΪ��ƿ���ʴ�Ϊ����ƿ��
��H2O2��MnO2�������·ֽ�����O2��H2O���÷�Ӧ�Ļ�ѧ����ʽΪ��2H2O2![]() 2H2O+O2�����ʴ�Ϊ��2H2O2
2H2O+O2�����ʴ�Ϊ��2H2O2![]() 2H2O+O2����
2H2O+O2����
�Ƿ�Ӧ�������¶ȡ�Ũ�ȡ�������Ӱ�죬����ʵ������ʵ�������¶���ͬ��Ũ�Ȳ�ͬ����˸�ʵ�����̽������Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬���豣֤��Ӧ�¶Ⱥʹ�����ͬ��������ô���Ϊ3��FeCl3��Һ���ʴ�Ϊ��̽����Ӧ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죻3��FeCl3��Һ��
�����ɼ���ʵ�����ݿɵã�����ʵ�������÷�Ӧ��Ũ�Ƚϴ���ͬʱ���ڲ�������������ϴ���˿ɵý��ۣ���������������ʱ����Ӧ��Ũ��Խ��Ӧ����Խ�죻�ʴ�Ϊ����������������ʱ����Ӧ��Ũ��Խ��Ӧ����Խ�졣
��������ʵ�����ݿ�֪�����������£�H2O2�ķֽ����ʸ��죻��Na2O2��K2O2��H2O��Ӧ�Ļ�ѧ����ʽ�ֱ�Ϊ��2Na2O2+2H2O = 4NaOH+O2����2K2O2+2H2O = 4KOH+O2��������KOH�ļ��Ա�NaOH�ļ���ǿ�����K2O2��H2O��Ӧ�ų���������ʽϿ죻�÷�Ӧ�Ļ�ѧ����ʽΪ��BaO2+H2SO4 = BaSO4+H2O2�����ڸ÷�Ӧ�����������½��У������������£�H2O2�ķֽ����ʽ�������˿��ø÷�Ӧ�Ʊ�H2O2���ʴ�Ϊ��K2O2��Ba2O2+H2SO4=BaSO4+H2O2���Ʊ�H2O2�Ļ���Ϊ���Ի�����H2O2�ķֽ����ʽ�����


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ(CuCl)�㷺Ӧ���ڻ�����ӡȾ����ҵ������ͭ����Ϊԭ������CuCl�Ĺ�����ͼ��
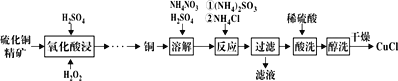
��֪CuCl�����ڴ���ˮ������c(Cl-)�ϴ����ϵ[CuCl(s)+Cl-![]() CuCl2-]����ʪ��������ˮ��������
CuCl2-]����ʪ��������ˮ��������
��1�������������ǰ�Ƚ�ͭ������Ŀ����__���ù���������ɫ��Һ��dz��ɫ��������Ӧ�Ļ�ѧ��Ӧ����ʽΪ__��
��2�����ܽ���ʱ��������Ũ��Ϊ0.3mol��L-1������1L��������Һ����Ҫ98%��1.84g��mL-1Ũ����__mL������1λС�������ܽ�ʱ��Ӧ�����ӷ���ʽ__��
��3������Ӧ��ʱ��Cu+�ij�����������NH4Cl������ϵ��ͼ��ʾ��
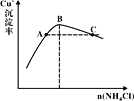
�ٷ�Ӧ������������___��n(������)��n(��ԭ��)=___��
�ڱȽ�c(Cu+)��Դ�С��A��___C�㣨����>������<������=������
����ߴ���C��״̬�Ļ������Cu+�����ʴ�ʩ��___��
��4����������������Һ��������Ҫ�ɷֵĻ�ѧʽΪ__��
��5��������������������������ϴ����������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cl2���仯�����������������о��й㷺����;������������ˮ���γ���������ˮ��ϵ��
���������գ�
��1����ԭ���������ӵĵ����Ų�ʽ��__��������Ų�ʽ��ȣ������ʾʽ�����˶Ժ�������˶�״̬��__������
��2���⡢�ȡ�������Ԫ�ظ����γ�һ�ּ������ӣ������Ӱ뾶�ɴ�С��˳��������Щ����__��
��3����������ˮ��ϵ�У����ڶ������Ԫ�ص�ƽ���ϵ����ֱ���ƽ�ⷽ��ʽ��ʾ��__����֪HClO��ɱ��������ClO��ǿ���ȴ�������ˮʱ�����ļ���ɱ��Ч�����ڶ��������ԭ����__��һ��ԭ�ɣ���
��4������ˮ�У����й�ϵ��ȷ����__��ѡ���ţ���
a c��HClO��+c��ClO����=c��H+����c��OH����
b c��H+��=c��ClO����+c��Cl����+c��OH����
c c��HClO����c��Cl����
d c��Cl������c��OH����
��5��ClO2��һ�ָ���Ч����ȫ������������ҵ�Ͽ���ClO2��ˮ�е�MnCl2�ڳ����·�Ӧ������MnO2�����ᣬ�Գ�ȥˮ��Mn2+��д���÷�Ӧ�Ļ�ѧ����ʽ������ƽ��__��������Ϊ����MnO2������������Ӧ����������������ʶ����__����������������������˵������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������H2��CO��CO2�Ļ������ͨ��ʢ������Na2O2��ĩ��Na2O2������Բ��ƣ����ܱ������У��õ����ȼֱ����Ӧ��ȫ���ָ���ԭ�¶ȣ������ڵ�ѹǿΪԭ����1/4����ԭ��������ƽ����Է�������������
A.20B.23C.30D.36
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(H2N2O2)��һ�ֶ�Ԫ�ᣬ��������N2O���塣
��1�������£���0.01mol��L-1��NaOH��Һ�ζ�10mL0.01mol��L-1H2N2O2��Һ�������ҺpH��NaOH��Һ����Ĺ�ϵ��ͼ��ʾ��
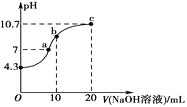
��д��H2N2O2��ˮ��Һ�еĵ��뷽��ʽ��__��
��c��ʱ��Һ�и�����Ũ���ɴ�С��˳��Ϊ__��
��b��ʱ��Һ��c(H2N2O2)__c(N2O22-)��(������������������=������ͬ)
��a��ʱ��Һ��c(Na+)__c(HN2O)+c(N2O22-)��
��2����������Һ����������������Һ��ϣ����Եõ���ɫ����������������������÷�ɢϵ�еμ���������Һ������ɫ�����ͻ�ɫ��������ʱ����ɢϵ��![]() =__��[��֪Ksp(Ag2N2O2)=4.2��10-9��Ksp(Ag2SO4)=1.4��10-5]
=__��[��֪Ksp(Ag2N2O2)=4.2��10-9��Ksp(Ag2SO4)=1.4��10-5]
��3����ʱ���ǽ�NaHCO3��Һ�е�ƽ���ʾΪ��2HCO3-![]() H2CO3+CO32-��Ϊ��֤����ƽ����ڣ�����ΪӦ��NaHCO3��Һ�м������������Լ�����___������ţ�
H2CO3+CO32-��Ϊ��֤����ƽ����ڣ�����ΪӦ��NaHCO3��Һ�м������������Լ�����___������ţ�
A.�ʵ�Ũ�ȵ�����
B.�ʵ�Ũ��Ba(OH��2��Һ
C.�ʵ�Ũ��BaCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ת������Դ���úͻ�����������Ҫ�о����⡣��H2S�Ϳ����Ļ������ͨ��FeCl2��CuCl2�Ļ����Һ�з�Ӧ����S��������ת����ͼ��ʾ������˵��������ǣ� ��
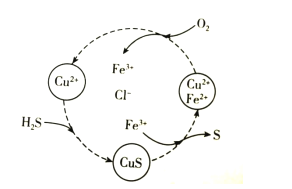
A.��ͼʾ��ת���У�Fe3+��CuS���м����
B.��ͼʾ��ת���У����ϼ۲����Ԫ��ֻ��ͭ
C.ͼʾת�����ܷ�Ӧ��2H2S+O2![]() 2S+2H2O
2S+2H2O
D.����1molH2Sת��Ϊ����ʱ����Ҫ����O2�����ʵ���Ϊ0.5mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ̽����Һ������Զ�FeCl3ˮ��ƽ���Ӱ�죬ʵ�鷽�����£�����50 mL 0.001 mol/L FeCl3��Һ��50mL��������Һx����������Һ�зֱ�μ�1��1 mol/L HCl��Һ��1��1 mol/L NaOH ��Һ�������ҺpH��ʱ��仯����������ͼ��ʾ��
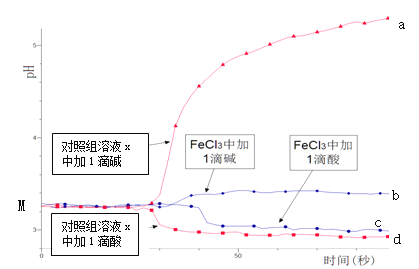
����˵������ȷ����
A.����M���Ӧ��pH��˵��Fe3+������ˮ�ⷴӦ
B.��������Һx����ɿ�����0.003 mol/L KCl
C.��������c��d˵��Fe3+ˮ��ƽ�ⷢ�����ƶ�
D.ͨ�����������ϵ���Ƕȵı仯���ɱ���ˮ��ƽ���ƶ��ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��������������������أ�����˵������ȷ����
A.�й�����FAST�õ���̼������һ���������ǽ�������
B.��ˮ���������Ư���Ժ����Ծ�����
C.��ʯ�͵��ѽ���Եõ���ϩ����ϩ����Ҫ��������ԭ��
D.ij��ˮ��Ʒ�ɼ������һ��ʱ�䣬pH��4.68��Ϊ4.28������ˮ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ��̬����������ܶȸߡ��ɱ��ͣ��乤��ԭ����ͼ��ʾ����缫a���ò���ʯīϩ��S8���ϣ��缫��ӦΪ:16Li+xS8=8Li2Sx��2��x��8��������˵����ȷ����
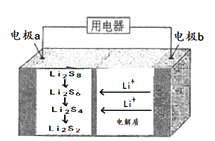
A. ��ع���ʱ�����·������0.02mol���ӣ��������ϼ���0.14g
B. �����м�������������ǿ������
C. ��س��ʱ��Խ��������е�Li2S2��Խ��
D. ��ع���ʱ�������ɷ�����Ӧ�� 2Li2S6+2Li++2e-=3Li2S4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com