
| 6.8×10-6 |
 ,
, .
.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:



| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
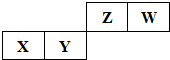 短周期元素X、Y、Z、W在周期表的位置如图所示,其中X元素所处的周期序数与族序数相等.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表的位置如图所示,其中X元素所处的周期序数与族序数相等.下列判断正确的是( )| A、气态氢化物的稳定性:Y>Z | B、一定条件下,Z单质与W的常见单质直接反应生成ZW2 | C、原子半径:X>Y>Z>W | D、Y、Z的最高价氧化物均为共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
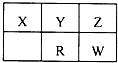 短周期元素X、Y、Z、R和W在元素周期表的位置如图所示,其中W元素族序数等于周期序数的2倍.则下列说法正确的是( )
短周期元素X、Y、Z、R和W在元素周期表的位置如图所示,其中W元素族序数等于周期序数的2倍.则下列说法正确的是( )| A、原子半径从小到大:X<Y<R<W | B、Z、W元素与X均可以形成AB2型化合物 | C、X有多种同素异形体,而Z不存在同素异形体 | D、Z的氢化物稳定性大于W的氢化物稳定性,是因为Z的氢化物分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素X、Y、Z关系如图,X原子的电子层数为n,最外层电子数为2n.W原子最内层电子数是最外层电子数的2倍.下列说法错误的是( )
短周期元素X、Y、Z关系如图,X原子的电子层数为n,最外层电子数为2n.W原子最内层电子数是最外层电子数的2倍.下列说法错误的是( )| A、X 和Y都是非金属元素,其中X最高化合价为+5价 | B、X、W的最高价氧化物在一定条件下能反应 | C、元素X、W和氧元素可形成化学式为W2XO3共价化合物 | D、Y、Z的氢化物的稳定性:Y<Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com