
| A. | 向氯化铝溶液中加入过量的氨水 | |
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| C. | 向稀硝酸中加入铁粉 | |
| D. | 向硫酸酸化的MgSO4溶液中加入过量的Ba(OH)2溶液 |
分析 A、氢氧化铝不溶于氨水;
B、向稀盐酸中滴入少量的NaAlO2溶液,溶液中存在NaCl、AlCl3等溶质;
C、向稀硝酸中加入铁粉可生成Fe(NO3)2、Fe(NO3)3等;
D、向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液,反应生成Mg(OH)2和BaSO4沉淀.
解答 解:A、氨水是弱碱,不能溶解氢氧化铝,氯化铝溶液加入过量氨水的反应方程式为:AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl,反应所得的溶液中溶质为过量的一水合氨和产物NH4Cl,故A错误;
B、向稀盐酸中滴入少量的NaAlO2溶液,溶液中存在NaCl、AlCl3等溶质,故B错误;
C、向稀硝酸中加入铁粉,如Fe过量,溶液中可能存在Fe(NO3)2、Fe(NO3)3等溶质,如Fe不足,则存在HNO3、Fe(NO3)3,故C错误;
D、向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液,反应生成Mg(OH)2和BaSO4沉淀,最后溶液中只有过量的Ba(OH)2,只有一种溶质,故D正确,故选D.
点评 本题考查元素化合物知识,题目难度不大,本题注意把握常见元素化合物的性质.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
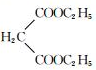 $→_{CH_{3}CH_{2}ONa}^{BrCH_{2}CH_{2}CH_{2}Br}$
$→_{CH_{3}CH_{2}ONa}^{BrCH_{2}CH_{2}CH_{2}Br}$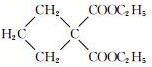 $→_{ii.H+/△}^{i.H_{2}O,OH-}$
$→_{ii.H+/△}^{i.H_{2}O,OH-}$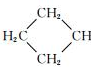 -COOH
-COOH
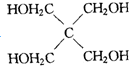 G
G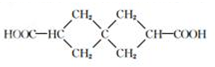
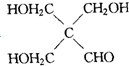
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镭的金属性比钙弱 | B. | 单质能与水反应生成氢气 | ||
| C. | 在化合物中呈+2价 | D. | 碳酸镭难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
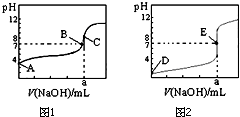 如图1、2为常温下用0.10mol•L-1 NaOH溶液滴定20.00mL 0.10mol•L-1 盐酸和20.00mL 0.10mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )
如图1、2为常温下用0.10mol•L-1 NaOH溶液滴定20.00mL 0.10mol•L-1 盐酸和20.00mL 0.10mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )| A. | 图1是滴定盐酸的曲线 | |
| B. | E点时溶液中离子浓度为c(Na+ )=c(A- ) | |
| C. | B点时,反应消耗溶液体积:V(NaOH)>V(HA) | |
| D. | 当0mL<V(NaOH)<20.00mL时,溶液中一定是c(A-)>c(Na+ )>c(H+ )>c(OH- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的H2S溶液中,c(H+)=c(HS一)=1×10-5mol•L-1 | |
| B. | 含有AgCl和AgI固体的悬浊液中,c(Ag+)>c(Cl-)=c(I-) | |
| C. | 在新制氯水中加入氯化钠固体,水的电离平衡不移动 | |
| D. |  若R为Zn,则如图采用了牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 10 | 40 | 75 |
| 剩余固体质量(g) | 201 | 132 | 72 |
| 温度(℃) | 10 | 40 | 75 |
| 溶解度 | 81 | 104 | 150 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com