
 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:分析 (1)装置D可将剩余的NO氧化成N03,金属铜和稀硝酸制得的一氧化氮中含有水,会和过氧化钠发生反应产生氧气,氧气极易把一氧化氮氧化;
(2)硝酸具有挥发性,会干扰实验结果,据此回答分析;
(3)根据5(NH4)2 Fe(SO4)2~MnO4-,消耗n(KMnO4)=0.1mol/L×0.01L=0.001mol,根据 2MnO4-~5NO2-,计算样品中NaN02的纯度;
(4)a.滴定至溶液紫色刚刚好褪去,消耗的(NH4)2 Fe(SO4)2偏小,导致的量结果偏高;
b.加入A与KMn04溶液前锥形瓶未经干燥,对测量结果无影响;
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中时间过长,部分(NH4)2 Fe(SO4)2被氧化,消耗的(NH4)2 Fe(SO4)2偏大,导致的量结果偏低.
解答 解:(1)高锰酸钾具有氧化性,能将一氧化氮氧化,反应的实质是:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,装置D可将剩余的NO氧化成N03,吸收多余的NO,如果没有B装置,C中发生的副反应有,金属铜和稀硝酸制得的一氧化氮中含有水,水会和过氧化钠发生反应产生氧气,2Na2O2+2H2O=4NaOH+O2↑,生成的氧气极易把一氧化氮氧化为二氧化氮,即2NO+O2=NO2,
故答案为:吸收多余的NO;2Na2O2+2H2O=4NaOH+O2↑、2NO+O2=NO2;
(2)由于获得一氧化氮所用的硝酸具有挥发性,获得NO的过程中会产生其他氮氧化物,这样会干扰实验结果,可以在A、B之间增加装有水的洗气瓶,减小实验误差;
故答案为:由于获得NO的过程中会产生其他氮氧化物;在A、B之间增加装有水的洗气瓶;
(3)根据5(NH4)2 Fe(S04)2~MnO4-,消耗n(KMn04)=0.1mol/L×0.01L=0.001mol,
2MnO4-~5NO2-,
2 5
0.05mol/L×0.024L-0.001mol x,
x=0.0005mol,100mL中n(NaN02)=0.0005mol×$\frac{100ml}{10ml}$=0.005mol,
则样品中NaN02的纯度为$\frac{0.005mol×69g/mol}{2.3g}$×100%=75%,
故答案为:75%;
(4)a.滴定至溶液紫色刚刚好褪去,消耗的(NH4)2 Fe(SO4)2偏小,导致的量结果偏高,故a不符合;
b.加入A与KMn04溶液前锥形瓶未经干燥,对测量结果无影响,故b符合;
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中时间过长,部分(NH4)2 Fe(SO4)2被氧化,消耗的(NH4)2 Fe(SO4)2偏大,导致的量结果偏低,故c符合;
故答案为:bc.
点评 本题是一道实验方案的设计和探究题,考查学生分析和解决问题的能力,主要是物质性质和化学反应定量关系的计算分析,综合性强,难度大.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 电子亚层(能级)是描述电子运动的电子云状态 | |
| B. | 只有在电子层、电子亚层、电子云的伸展方向及电子的自旋都确定时,电子的运动状态才能确定下来 | |
| C. | 必须在B项所述四个方面都确定时,才能决定组成每一能层的最多轨道数 | |
| D. | 电子云伸展方向与能量大小是无关的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中加入过量的氨水 | |
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| C. | 向稀硝酸中加入铁粉 | |
| D. | 向硫酸酸化的MgSO4溶液中加入过量的Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.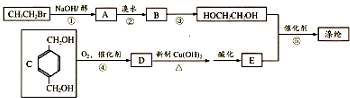
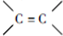 ,反应①、②的反应类型分别为消去反应、加成反应,有机物B的名称是1,2-二溴乙烷,反应③可用的试剂为氢氧化钠水溶液;
,反应①、②的反应类型分别为消去反应、加成反应,有机物B的名称是1,2-二溴乙烷,反应③可用的试剂为氢氧化钠水溶液; ;
;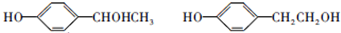 ;
;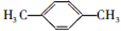 ;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构有4种.
;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构有4种.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等物质的量浓度的Na2 C O3和NaHCO3混合液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 25℃时 0.2 mol•L-1盐酸与等体积0.05 mol•L-1Ba(OH)2溶液混合后,溶液的pH=l | |
| C. | pH=3的二元弱酸H2R溶液与pH=ll的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)十c(HR-)=c(Na+) | |
| D. | 25℃时,若0.3 mol•L-1 HY溶液与0.3 mol.L-lNaOH溶液等体积混合后,溶液的 pH=9,则:c(OH-)-c(HY)-c(H+)=1×lO-9 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

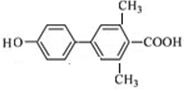
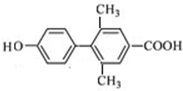
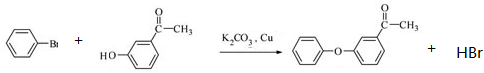 .
. 、
、 、
、 、
、 (其中一种).
(其中一种).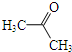 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子与原子之间 | B. | 分子与分子之间 | C. | 离子与离子之间 | D. | 离子与电子之间 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com