
脑白金又名褪黑素,据报道它具有提高免疫力、促进睡眠等功效,其结构简式为:
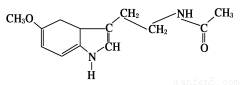
下列关于脑白金说法不正确的是( )
A.能发生加成反应
B.属于芳香族化合物
C.分子式为C13H18N2O2
D.能使酸性高锰酸钾溶液褪色
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:选择题
某电荷数小于18的元素X,其原子核外电子层数为a,最外层电子数为(2a+1)。下列有关元素X的说法中,不正确的是 ( )
A.元素X的原子核内质子数为(2a2-1)
B.元素X形成的单质既能作氧化剂又能作还原剂
C.元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数)
D.由元素X形成的某些化合物,可能具有杀菌消毒的作用
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.蛋白质、淀粉、纤维素和油脂都是高分子有机物
B.苯和乙酸乙酯都能发生取代反应
C.煤干馏可得苯及甲苯等,是由于煤中含有苯及甲苯等物质
D.淀粉、纤维素和蛋白质水解都生成葡萄糖
查看答案和解析>>
科目:高中化学 来源:2015届湖南省益阳市高二下学期第一次月考化学试卷(解析版) 题型:选择题
25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃8mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了18mL,原混合烃中乙炔的体积分数为( )
A.12.5% B.25% C.50% D.75%
查看答案和解析>>
科目:高中化学 来源:2015届湖南省益阳市高二下学期第一次月考化学试卷(解析版) 题型:选择题
分子式为C5H10的烯烃共有(要考虑顺反异构体)( )
A.5种 B.6种 C.7种 D.8种
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:填空题
铁和铁的化合物用途广泛。请回答下列问题:
(1)写出在潮湿空气中钢铁锈蚀时正极反应的电极反应式:_______________________。
将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:______________________________________。
(2)爱迪生蓄电池的反应式为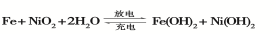
①爱迪生蓄电池的正极是 , 该电池工作一段时间后必须充电,充电时生成Fe的反应类型是______。
②高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。写出在用电解法制取高铁酸钠时,阳极的电极反应式___________________________________。
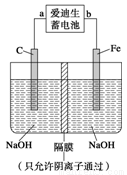
③你认为高铁酸钠作为一种新型净水剂的理由错误的是 ______。
a.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
b.高铁酸钠在消毒杀菌时被还原生成Fe3+,Fe3+水解产生氢氧化铁胶体能吸附悬浮杂质
c.高铁酸钠具有强氧化性,能消毒杀菌
d.高铁酸钠具有强还原性,能消毒杀菌
(3)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4︰5,其中Fe2+与Fe3+物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:选择题
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)  2NH3(g)(正反应为放热反应)。下列说法错误的是
2NH3(g)(正反应为放热反应)。下列说法错误的是
A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大
B.升高平衡体系的温度(保持体积不变),混合气体的密度不变
C.当反应达到平衡时,N2和H2的浓度比是 1∶3
D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:填空题
如图是8种有机化合物的转换关系:
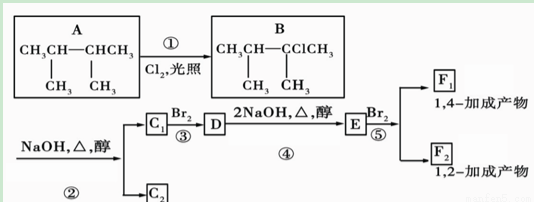
请回答下列问题:
(1)根据系统命名法,化合物A的名称是________。
(2)上述框图中,①是______反应,③是______反应(填反应类型)。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:________________________。
(4)C1的结构简式是____________ __;F1的结构简式是__ __________ ___。F1与F2的关系为________。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末质量检测化学试卷(解析版) 题型:选择题
盖斯定律认为:不管化学过程是一步或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)= H2O(l) △H1 =-Q1 kJ·mol-1(Q1>0)
C2H5OH(g)= C2H5OH(l) △H2 =-Q2 kJ·mol-1(Q2>0)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3 = -Q3 kJ·mol-1(Q3>0)若使23g液态乙醇完全燃烧,最后恢复到室温,则放出的热量为(kJ)
A.Q1+ Q2+Q3 B.0.5(Q1+Q2+Q3 )
C.0.5 Q1-1.5 Q2+0.5Q3 D.1.5 Q1-0.5 Q2+0.5Q3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com