
| A、11.2g | B、5.6g |
| C、2.8g | D、1.4g |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在水中溶解性:Na2CO3<NaHCO3 |
| B、热稳定性:Na2CO3>NaHCO3 |
| C、同浓度溶液与足量酸反应的速度:Na2CO3>NaHCO3 |
| D、将固体溶于少量水放出的热量:Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该合金的熔点高于金属钠的熔点 |
| B、若将钠铝合金投入水中得到无色溶液且无固体剩余,则n(Al)>n(Na) |
| C、若将钠铝合金投入FeCl3溶液中有Fe(OH)3沉淀生成 |
| D、等质量的钠铝合金中铝的含量越大,与足量盐酸反应时放出的氢气越少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HIO与HCN均为含有极性键的直线形极性分子 |
| B、SiO2与C02均为每摩含有4×6.02×1023对共用电子对的酸性氧化物 |
| C、Na2S浓溶液与稀盐酸分别滴加到饱和AgCl溶液中均一定有沉淀产生 |
| D、明矾与离子交换树脂均能将海水进行淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制造钢轨的材料是钢,钢是用量最大的合金 |
| B、钢的熔点比铁的熔点高,而铁的用途更广泛 |
| C、我国在商代就开始使用铜合金 |
| D、铝合金的强度、硬度比组成合金各成分金属的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
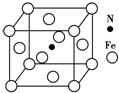 铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂.
铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com