考点:化学平衡的计算,反应速率的定量表示方法,化学平衡建立的过程,化学平衡的影响因素
专题:
分析:(1)①化学平衡常数K=[NH
3][HI];
②减小压强,平衡向气体体积增大的方向移动;
(2)a.单位时间内生成2n molNH
3的同时生成3n molH
2,该反应达到平衡状态;
b.单位时间内生成6nmolN-H键时消耗3nmolH-H键,实际上同时生成2n molH-H键,则v(正)>v(逆);
c.用N
2、H
2、NH
3的物质的量浓度变化表示的反应速率之比为1:3:2,该反应不一定向正反应方向移动;
d.混合气体的平均摩尔质量增大,混合气体的质量不变,则混合气体的物质的量减小,平衡向气体体积减小的方向移动;
e.容器内的气体密度始终不变;
(3)①根据氮气和反应热之间的关系式计算;
②先计算正确的平均反应速率,再根据同一可逆反应中,同一时间段内各物质的反应速率之比等于其计量数之比计算氮气反应速率;
③2h时,△n(N
2)=(1.50-1.20)mol=0.30mol,根据N
2---2NH
3之间的关系式得△n(NH
3)=2△n(N
2)=0.60mol,3h和4h时,各物质的物质的量不变,则该反应达到平衡状态,化学平衡常数K=
;
④根据浓度商和平衡常数相对大小判断反应方向;
(4)根据一水合氨电离方式书写N
2H
4?2H
2O电离方程式.
解答:
解:(1)①化学平衡常数K=[NH
3][HI],故答案为:K=[NH
3][HI];
②方程式a是反应前后气体体积增大的反应,b方程式反应前后气体体积不变,所以增大容器体积,压强减小,平衡向气体体积增大的方向移动,所以平衡向正反应方向移动,因为容器体积增大,平衡时气体颜色变浅,故答案为:正向;变浅;
(2)a.单位时间内生成2nmolNH
3的同时消耗3nmolH
2,同时生成3n molH
2,则氢气的正逆反应速率相等,所以该反应达到平衡状态,故错误;
b.单位时间内生成6nmolN-H键时消耗3nmolH-H键,实际上同时生成2n molH-H键,则v(正)>v(逆),则平衡向在反应方向移动,故正确;
c.用N
2、H
2、NH
3的物质的量浓度变化表示的反应速率之比为1:3:2,无论该反应是否达到平衡状态都存在反应速率之比为1:3:2,所以不能确定该反应向正反应方向移动,故错误;
d.混合气体质量不变,如果混合气体的平均摩尔质量增大,则平衡向气体体积减小的正反应方向移动,故正确;
e.混合气体质量不变,容器体积不变,所以容器内的气体密度始终不变,故错误;
故选:bd;
(3)①该反应有1mol氮气参加反应放出92.60kJ热量,则生成(1.50-1.20)mol氮气参加反应放出的热量=
=27.78kJ,故答案为:27.78;
②2h内,v(NH
3)=
=0.1mol/(L.h),同一可逆反应中,同一时间段内各物质的反应速率之比等于其计量数之比,所以v(N
2)=
v(NH
3)=0.05mol/(L.h),
故答案为:0.05;
③2h时,△n(N
2)=(1.50-1.20)mol=0.30mol,根据N
2---2NH
3之间的关系式得△n(NH
3)=2△n(N
2)=0.60mol,3h和4h时,各物质的物质的量不变,则该反应达到平衡状态,c(NH
3)=
=0.5mol/L,c(N
2)
=
=0.5mol/L,c(H
2)=
=1.5mol/L,
化学平衡常数K=
=
=0.15,
故答案为:0.15;
④再加入N
2、H
2和NH
3各1.00mol,c(NH
3)=1mol/L,c(N
2)=1mol/L,c(H
2)=2mol/L,
浓度商=
=0.125<K,则平衡向正反应方向移动,故答案为:正反应;
(4)肼(N
2H
4)的性质类似于NH
3,极易溶于水,与水反应生成一种二元弱碱N
2H
4?2H
2O,该二元弱碱电离,电离方程式为:N
2H
4?2H
2O?[N
2H
5?H
2O]
++OH
-,
故答案为:N
2H
4?2H
2O?[N
2H
5?H
2O]
++OH
-.
点评:本题考查了化学平衡的有关知识,涉及化学平衡常数的有关计算、化学平衡状态的判断、化学反应速率的计算等知识点,根据平衡常数公式、正逆反应速率相等、化学反应速率公式进行分析解答即可,注意化学平衡状态的判断中,只有反应前后改变的物理量,才能作为化学平衡状态的判断依据,题目难度中等.



 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
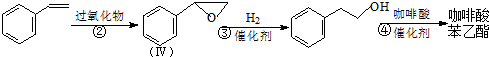
 的芳香化合物共有5种
的芳香化合物共有5种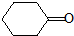 )与化合物Ⅱ也能发生反应①的反应,则其生成含羧基的化合物的结构简式为
)与化合物Ⅱ也能发生反应①的反应,则其生成含羧基的化合物的结构简式为
 甲醇是主要的化学工业基础原料和清洁液体燃料.工业上可以用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
甲醇是主要的化学工业基础原料和清洁液体燃料.工业上可以用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示: