
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol H2 1mol I2 | 2mol HI | 4mol HI |
| HI的浓度 | c1 | c2 | c3 |
| 反应的能量变化 | 放出akg | 吸收bkg | 吸收ckg |
| 反应物转化率 | α1 | α2 | α3 |
| A、2α1=α3 |
| B、α1+α2=1 |
| C、c1=c2=c3 |
| D、a+b=14.9 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
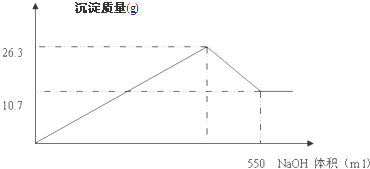
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Fe2+、NO3-、Na+ |
| B、氨水中:Al3+、SO42-、Mg2+ |
| C、容器底部有硫粉:Fe3+、Cu2+、Cl- |
| D、NaNO3溶液中:Al3+、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
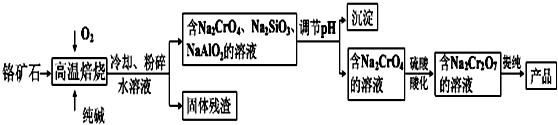
| 3 | 0.4 |
| 3 | 4 |
| 3 | 6 |
| 3 | 60 |
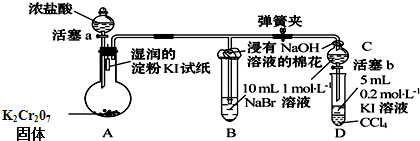
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | K2SO4、BaCl2、NH4NO3 |
| 乙 | NaCl、Ca(OH)2、K2CO3 |
| 丙 | HCl、Na2SO4、NaCl |
| 丁 | K2SO4、Na NO3、KCl |
| A、甲 | B、乙 | C、丙 | D、丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com