
 ;故答案为:
;故答案为: ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
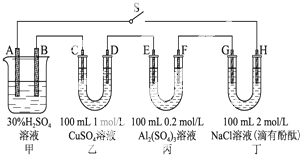 如图示的四个容器中分别盛有不同的溶液,除A、B外,其余电极均为石墨电极.甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4
如图示的四个容器中分别盛有不同的溶液,除A、B外,其余电极均为石墨电极.甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4
| ||
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol H2 1mol I2 | 2mol HI | 4mol HI |
| HI的浓度 | c1 | c2 | c3 |
| 反应的能量变化 | 放出akg | 吸收bkg | 吸收ckg |
| 反应物转化率 | α1 | α2 | α3 |
| A、2α1=α3 |
| B、α1+α2=1 |
| C、c1=c2=c3 |
| D、a+b=14.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定没有N2,CO和HCl中至少有一种 |
| B、一定没有N2,CO和HCl都有 |
| C、一定有N2,CO和HCl中至少有一种 |
| D、一定有N2和HCl,肯定没有CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)下列实验操作中,错误的是
(1)下列实验操作中,错误的是查看答案和解析>>
科目:高中化学 来源: 题型:

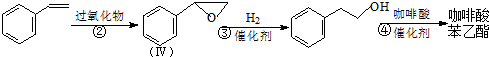
 的芳香化合物共有5种
的芳香化合物共有5种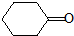 )与化合物Ⅱ也能发生反应①的反应,则其生成含羧基的化合物的结构简式为
)与化合物Ⅱ也能发生反应①的反应,则其生成含羧基的化合物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、植物油不能使溴的四氯化碳溶液褪色 |
| B、淀粉和纤维素都可以作为工业上生产葡萄糖的原料 |
| C、糖类、油脂、蛋白质在一定条件下都能发生水解反应 |
| D、蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com