
| A、0.4mol/L |
| B、0.3mol/L |
| C、0.2mol/L |
| D、0.1mol/L |
| m |
| M |
| 3 |
| 2 |
| n |
| V |
| 1.62g |
| 27g/mol |
| 3 |
| 2 |
| 3 |
| 2 |
| 0.08mol |
| 0.3L+0.1L |


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
| A、原子最外层有2个电子的元素,不一定是第2列元素 |
| B、第3~12列元素全为金属 |
| C、第17列元素的原子,其半径越大,越容易失去电子 |
| D、每列元素的单质,从上到下,熔沸点均依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150 mL 2mol?L-1的NaCl溶液 |
| B、75mL 1mol?L-1的CaCl2溶液 |
| C、200mL 4mol?L-1的KCl溶液 |
| D、50 mL 1mol?L-1的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
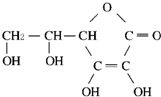 维生素C的结构如图所示,下列叙述中错误的是( )
维生素C的结构如图所示,下列叙述中错误的是( )| A、维生素C的分子式为C6H8O4 |
| B、维生素C高温时不稳定,所以生吃蔬菜水果比熟吃维生素C的损失少 |
| C、维生素C能发生加成反应 |
| D、维生素C添加到食品中既可以作防腐剂也可以作营养强化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度相同、体积相同的O2和N2 |
| B、质量相等、密度不等的N2和C2H4 |
| C、体积相同、密度相等的CO和C2H4 |
| D、压强相同,体积相同的O2和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强碱性溶液中:K+、Al3+、Cl-、SO42- |
| B、室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SiO32- |
| C、AlO2-浓度为0.1 mol?L-1的溶液中:Na+、K+、HCO3-、Cl- |
| D、H+浓度为1×10-13mol?L-1的溶液中,Na+、K+、Cl-、NO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验做完后,直接用嘴吹灭酒精灯 |
| B、浓硫酸沾到皮肤上时,立即用湿抹布冲洗,然后涂上3%~5%的NaOH溶液 |
| C、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中含有1mol NaCl |
| B、1L溶液中含有58.5g NaCl |
| C、1mol NaCl溶于1L水中 |
| D、58.5g NaCl溶于941.5g水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com