
为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
| 编号 | 电极材料 | 电解质溶液 | 电子流向 |
| ① | Mg—Al | HNO3(浓) | Mg→Al |
| ② | Mg—Al | HCl(aq) | Mg→Al |
| ③ | Mg—Al | NaOH(aq) | Al→Mg |
| ④ | Al—Cu | HNO3(浓) | Cu→Al |
根据以上表格内容回答:
(1)实验1中Mg作___________(填正极或负极),发生__________(氧化反应或还原反应) 实验3中Mg作___________,发生__________(氧化反应或还原反应)
(2) 实验2中Mg电极反应式为__________________。
Al电极上的电极反应式为_________________________,总的电池反应是_______________________________。
科目:高中化学 来源: 题型:
卤族元素随着原子序数的增大,下列递变规律正确的是
A.原子半径逐渐增大 B.单质的氧化性逐渐增强
C.单质熔、沸点逐渐降低 D.气态氢化物稳定性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ、(7分)在一定条件下,将 2 molA 和 2 molB 混合于容积为 2L 的密闭容器中,发生如下反应:
3A ( g ) + B ( g )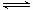 xC ( g ) + 2D ( g )。 2 min 末反应达到平衡状态时,生成 0.8molD ,同时测得 C 的浓度为 0.4 mol·L一1。请填写下列空白:
xC ( g ) + 2D ( g )。 2 min 末反应达到平衡状态时,生成 0.8molD ,同时测得 C 的浓度为 0.4 mol·L一1。请填写下列空白:
(1)x =_________;用 D 的浓度变化表示的化学反应速率为___________________
(2)A 的平衡浓度为_______________________ , B 的转化率为_____________。
(3)如果增大体系的压强,则平衡体系中 C 的体积分数将____________(填“增大”、“减小”或“不变”)。
Ⅱ、(12分)在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:CO2(g)+H2(g)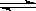 CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应
CO(g)+H2O(g)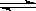 CO2(g)+H2(g)的平衡常数K2=________,
CO2(g)+H2(g)的平衡常数K2=________,
反应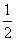 CO2(g)+
CO2(g)+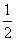 H2(g)
H2(g)
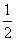 CO(g)+
CO(g)+ H2O(g)的平衡常数K3=________。
H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2 D.混合气体的平均相对分子质量不变
(5)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v(正)________v(逆)(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
海带中含碘元素。从海带中提取碘有如下步骤:①通入足量Cl2;②将海带焙烧成灰后加水搅拌;③加CCl4振
荡;④用分液漏斗分液;⑤过滤。合理的操作顺序是( )
A.①②③④⑤ B.②⑤①③④ C.①③⑤②④ D.②①③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
用电子式表示物质的形成过程
(1)共价分子——左写原子的电子式(相同原子可合并),右写分子的电子式,中间用“―→”连接即可。如:
N2________________________________________________________________________
NH3________________________________________________________________________
CO2________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种非 金属元素具有相同的电子层数,它们的气态氢化物的稳定性的强弱顺序为XH3<H2Y<HZ,则三种元素的非金属性和简单阴离子的还原性强弱顺序如何?
金属元素具有相同的电子层数,它们的气态氢化物的稳定性的强弱顺序为XH3<H2Y<HZ,则三种元素的非金属性和简单阴离子的还原性强弱顺序如何?
查看答案和解析>>
科目:高中化学 来源: 题型:
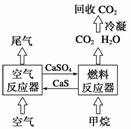 直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸钙。硫酸钙可在下图所示的循环燃烧装置的燃料反应器中与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于二氧化碳的回收利用,达到减少碳排放的目的。
直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸钙。硫酸钙可在下图所示的循环燃烧装置的燃料反应器中与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于二氧化碳的回收利用,达到减少碳排放的目的。
请回答下列问题:
(1)煤燃烧产生的烟气直接排放到空气中,引发的主要环境问题有______(填写字母编号)。
A.温室效应 B.酸雨
C.粉尘污染 D.水体富营养化
(2)在烟气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
①二氧化碳与石灰石浆液反应得到的产物为__________。
②亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2005年诺贝尔化学奖被授予“在烯烃复分解反应研究方面作出贡献”的三位科学家。“烯烃复分解反应”是指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程。如2分子烯烃RCH=CHR'用上述催化剂作用会生成两种新的烯烃RCH=CHR和R'CH=CHR'。则分子式为C4H8的烯烃中,任取两种发生“复分解反应”,生成新烯烃种类最多的一种组合中,其新烯烃的种类为( )
A.5种 B.4种 C.3 种 D.2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com