
卤族元素随着原子序数的增大,下列递变规律正确的是
A.原子半径逐渐增大 B.单质的氧化性逐渐增强
C.单质熔、沸点逐渐降低 D.气态氢化物稳定性逐渐增强
科目:高中化学 来源: 题型:
二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是
A.利用金属钠或者金属钾 B.利用质谱法
C.利用红外光谱法 D.利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是( )
A.Y的阴离子Y—的还原性强于X的阴离子X—
B.X的氢化物的水溶液的酸性比Y的氢化物的水溶液的酸性强
C.X的单质X2能将Y的阴离子Y—氧化成Y2
D.X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: _______________________________
 (2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图,标出正、负极及材料、电解质溶液并写出电极反应式。
(2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图,标出正、负极及材料、电解质溶液并写出电极反应式。
正极反应____________________________;
负极反应____________________________。
(3)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答下列问题:
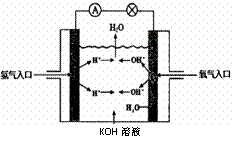 ①负极反应式为
①负极反应式为
正极反应式为
溶液PH (填“增大”、“不变”或“减小”)。
 ②该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
②该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LiH Ⅱ.LiH+H2O=LiOH+H2↑
反应Ⅰ中的还原剂是 ,7 gLi可吸收标况下H2 L,此时转移电子 moL。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知正四面体形分子E和直线型分子G反应,生成四面体形分子LL和直线型分子M。(组成E分子的元素的原子序数小于10,组成G分子的元素为第三周期的元素。)如下图, 则下列判断中正确的是

A.常温常压下,L是一种液态有机物 B.E是一种含非极性键的分子
C.干燥的G能漂白有色物质 D.上述反应的类型是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示:

(1)A中反应的离子方程式是____________________________________
(2)B中Sn极的电极反应式为_________,Sn极附近溶液的酸性_________(填“增强”“减弱”或“不变”)。
(3) C中被腐蚀的金属是_________ ,比较A、B、C中铁被腐蚀的速率由快到慢的顺序是___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.25℃,pH=13的Ba(OH)2溶液和pH=l的HCl溶液中均存在: c(H十)·c(OH—)=1X10-14:]
B.将一定体积醋酸溶液加水至原来的m倍,则pH增大m个单位
C. 25℃,pH=8的NaOH溶液和NH3·H2O溶液中,由水电离出的c(OH—)不相等
D.在NaHCO3溶液中:c (Na+)=c(HCO3-)+c(CO32—)
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
| 编号 | 电极材料 | 电解质溶液 | 电子流向 |
| ① | Mg—Al | HNO3(浓) | Mg→Al |
| ② | Mg—Al | HCl(aq) | Mg→Al |
| ③ | Mg—Al | NaOH(aq) | Al→Mg |
| ④ | Al—Cu | HNO3(浓) | Cu→Al |
根据以上表格内容回答:
(1)实验1中Mg作___________(填正极或负极),发生__________(氧化反应或还原反应) 实验3中Mg作___________,发生__________(氧化反应或还原反应)
(2) 实验2中Mg电极反应式为__________________。
Al电极上的电极反应式为_________________________,总的电池反应是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com