
| A. SO2具有漂白性,能使FeCl3、KMnOpK溶液迅速褪色 |
| B.可以用品红溶液鉴别SO2和CO2 |
| C.硫粉在过馈的纯氧中燃烧可以生成SO3 |
| D. SO2有漂白性,Cl2也有漂白性,两者同吋使用效果会更好 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:实验题

 。
。 量的测量结果比实际值________(填“偏高”、“偏低”或“没影响”)。
量的测量结果比实际值________(填“偏高”、“偏低”或“没影响”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓H2SO4有氧化性,稀H2SO4无氧化性 |
| B.由于浓H2SO4具有吸水性,故可用来与蔗糖反应做“黑面包”实验 |
| C.稀H2SO4与铁、铝反应,浓H2SO4在常温下不与铁、铝反应 |
| D.浓硫酸与Cu的反应中有少量黑色固体生成,可能是CuO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。
验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
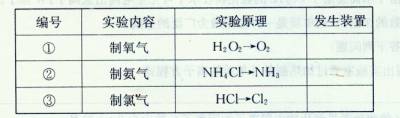
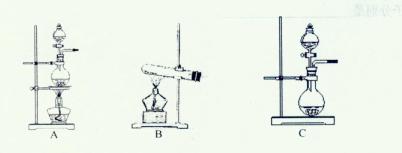
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com