
甲、乙的实验装置如图所示,丙、丁分别是氯碱工业生产示意图和制备金属钛的示意图。
请回答下列问题:
(1)写出甲装置中碳棒表面的电极反应式:_________________________
(2)已知:5Cl2+I2+6H2O=10HCl+2HIO3。若将湿润的淀粉KI试纸置于乙装置中的碳棒附近,现象为________________________________;若乙装置中转移0.02 mol电子后停止实验,烧杯中溶液的体积为200 mL,则此时溶液的pH=________。(室温条件下,且不考虑电解产物的相互反应)
(3)工业上经常用到离子交换膜,离子交换膜有阳离子交换膜和阴离子交换膜两种,阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。当乙装置中的反应用于工业生产时,为了阻止两极产物之间的反应,通常用如丙图所示的装置,Na+的移动方向如图中标注,则H2的出口是________(填“C”、“D”、“E”或“F”);________(填“能”或“不能”)将阳离子交换膜换成阴离子交换膜。
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaO作电解质,利用丁装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极的电极反应式:_____________________________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)____________________________________ __。
③电解过程中需定期更换阳极材料的原因是
___________________ __________________________________________
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
按下图所示装置进行实验,并回答下列问题: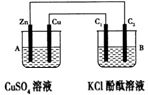
(1)判断装置的名称:A池为 ,B池为 。
(2)锌极为 极,电极反应式为 ;铜极为 极,电极反应式为 ;石墨棒C1为 极,电极反应式为 ;石墨棒C2附近发生的实验现象为 ,反应结束后,B池溶液的pH值 。(增大、减小、不变,忽略气体溶于水) 。
(3)当C2极析出224 mL气体(标准状况下),锌的质量 (增加或减少) g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
(1)X极与电源的 (填“正”或“负”)极相连,氢气从 (选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为 (填“阴离子”或“阳离子”,下同)交换膜,N为 交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为 。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是 ,转移的电子数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
防止钢铁的腐蚀是世界级难题,每年全世界钢产量的四分之一因腐蚀而损失,根据下图回答:
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为________________________。
(2)为降低某水库的铁闸门的被腐蚀速率,可以采用图甲方案,其中焊接在铁闸门上的固体材料R可以采用__________。
| A.铜 | B.钠 | C.锌 | D.石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下:
请回答:
(1)已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是____价。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成____。
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:
为了加快该反应的反应速率,可采取的措施是____。
(4)已知CrO42—在不同的酸性溶液中有不同的反应,如:
①往混合溶液甲中加入硫酸必须适量的原因是____。
②混合溶液乙中溶质的化学式是____。
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72—必须除去。工业上可用电解法来处理含Cr2O72—的废水,下图为电解装置示意图(电极材料分别为铁和石墨)。通电后,Cr2O72—在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去。
a电极的电极反应式是 ,
b电极附近反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地往烧杯中央滴入CuSO4溶液。
(1)片刻后可观察到的现象是(指悬吊的金属圈)________。
| A.铁圈和银圈左右摇摆不定 |
| B.保持平衡状态不变 |
| C.铁圈向下倾斜 |
| D.银圈向下倾斜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铅蓄电池是典型的可充电电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42— 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
放电时:正极的电极反应式是______________________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为相互串联的甲、乙两电解池。试回答:
(1)若甲电解池利用电解原理在铁上镀铜,则A是 、 (填电极材料和电极名称),电极反应是 ;B是(要求同A) 、 ,电极反应是 ,应选用的电解质溶液是 ;乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色。
(2)若甲电解池阴极增重1.28g,乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol/L,溶液的pH等于 。
(3)若甲电解池以I=0.21A的电流电解60min后阴极增重0.25g,则此实验测得的阿伏加德罗常数NA为多少(已知电子电量e—=1.60×10—19C)?(简要写计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电浮选凝聚法处理酸性污水的工作原理如图所示。下列说法不正确的是
A.铁电极的电极反应式为: |
B.通人空气的石墨电极的电极反应式为 |
| C.若左池石墨电极产生44. 8L(标准状况)气体,则消耗氧气0. 5mol |
| D.为增强污水的导电能力,可向污水中加入适量工业用食盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com