
| A. | ②③ | B. | ①③ | C. | ①④ | D. | ③④ |
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,氧化剂与还原剂不一定是两种不同的反应物 | |
| B. | 在氧化还原反应中,生成物不一定是氧化产物或还原产物 | |
| C. | 元素由化合态转化为游离态时,该元素一定被还原 | |
| D. | 有单质参加的反应不一定属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
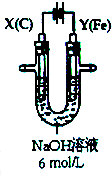 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
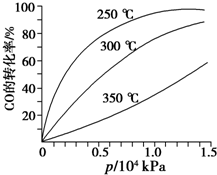 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极反应为2n-2e-+20H一═Zn(OH)2 | |
| B. | 充电时,阴极pH增大 | |
| C. | 放电时,若有6mol电子转移,则正极有10 mol OH一移向负极 | |
| D. | 充电时,阳极反应为Fe(OH)3+50H一+3e一=Fe042-+4H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1、2 | B. | 1、1 | C. | 2、1 | D. | 2、3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| B. | 加水,反应速率增大,平衡向逆反应方向移动 | |
| C. | 滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:2 | ||
| C. | 有机物一定是CH4 | D. | 有机物可能是CH4O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com