
| A. | 根据水溶液能否导电将化合物分为电解质和非电解质 | |
| B. | 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 | |
| D. | 根据能否与碱溶液反应,可将氧化物分为酸性氧化物和碱性氧化物 |
分析 A.在水溶液或熔融状态下能导电的化合物为电解质,反之为非电解质;
B.化学反应中元素化合价发生变化是氧化还原反应;
C.分散系的分类依据是分散质微粒直径大小分析判断;
D.酸性氧化物、碱性氧化物的分类是依据氧化物的性质进行分类.
解答 解:A.电解质和非电解质都必须是化合物,根据化合物在水溶液或是熔融状态下能否导电将化合物分为电解质和非电解质,水溶液中或熔融状态导电的化合物为电解质,故A错误;
B.化学反应中元素化合价是否发生变化把反应分为氧化还原反应和非氧化还原反应,故B正确;
C.根据分散系分散质微粒直径将分散系分为溶液、胶体和浊液,溶液中分散质微粒直径小于1nm,胶体分散质微粒直径介于1~100nm之间,浊液分散质微粒直径大于100nm,丁达尔现象是胶体性质之一,不是分散系分类标准,故C错误;
D.酸性氧化物是与碱反应生成盐和水的氧化物,碱性氧化物是与酸反应生成盐和水的氧化物,既能与碱反应生成盐和水,又能与酸反应生成盐和水的氧化物为两性氧化物,依据氧化物性质把氧化为分为酸性氧化物、碱性氧化物和两性氧化物,故D错误;
故选B.
点评 本题考查电解质与非电解质、氧化还原反应、分散系、氧化物分类的依据分析判断,掌握基础是解题关键,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:填空题
| 类别 | 编号 |
| 新能源 | |
| 常规能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Fe | Cu | Zn | Ag | Au | W | |
| 熔点/℃ | 1535 | 1083 | 419.5 | 960.8 | 1063 | 3380 |
| 沸点/℃ | 3000 | 2595 | 907 | 2212 | 2707 | 5627 |
| A. | Fe、Ag | B. | Ag、Au | C. | Zn、W | D. | Fe、Au |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
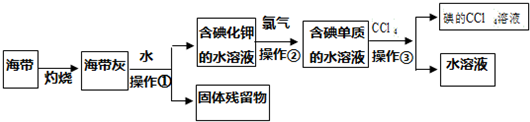
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeSO4酸性溶液暴露在空气中:2Fe2++O2+4H+=2Fe3++2H2O | |
| B. | MgSO4溶液滴入到Ba(OH)2溶液中:SO42-+Ba2+=BaSO4↓ | |
| C. | 向NaAlO2溶液中通入足量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- | |
| D. | FeCl3溶液中加入少量NaHS溶液:Fe3++3HS-+3H2O=Fe(OH)3↓+3H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- | |
| B. | 中性溶液中:Fe3+、MnO4-、SO42-、K+ | |
| C. | 酸性溶液中:Na+、ClO-、SO42-、I- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com