
【题目】新型NaBH4/H2O2燃料电他(DBFC)的结构如下图.该电池总反应方程式:NaBH4+4H2O2=NaBO2+6H2O,有关的说法正确是( )
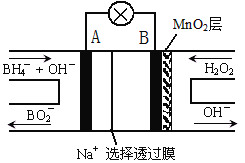
A.电池正极区的电极反应为:BH4-+8OH--8e-=BO2-+6H2O
B.电极B为负极,纳米MnO2层的作用是提离原电池的工作效率
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12NA
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( )

A.1mol分枝酸最多可与3molNaOH发生中和反应
B.可与乙醇、乙酸反应,且反应类型相同
C.分子中含有2 种官能团
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色.且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类、脂肪和蛋白质的叙述正确的是
A. 蛋白质溶液遇CuSO4后产生的沉淀能重新溶解 B. 淀粉水解的最终产物是葡萄糖
C. 葡萄糖能发生氧化反应和水解反应 D. 植物油不能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季的降雪给机场和马路带来诸多不便,其中醋酸钾(CH3COOK)是融雪效果较好的融雪剂,下列关于醋酸钾说法正确的是
A.1 mol CH3COOK的质量为98 g·mol-1
B.CH3COOK的摩尔质量等于它的相对分子质量
C.一个CH3COOK微粒的质量约为![]() g
g
D.含有6.02×1023个碳原子的CH3COOK的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5kJ·mol﹣1,ΔH2=-395.4kJ·mol﹣1,下列说法或表示式正确的是( )
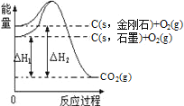
A.C(s,石墨)=C(s,金刚石) ΔH=-1.9 kJ·mol﹣1
B.石墨和金刚石的转化是物理变化
C.石墨的稳定性强于金刚石
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4在实验室和工业生产中有广泛用途。
Ⅰ.某小组拟用酸性KMnO4溶液与H2C2O4溶液(弱酸)的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。(已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O)
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L KMnO4溶液)/mL | m(MnSO4固体)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.0 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题:
(1)完成上述反应原理的离子反应方程式_______________________。
(2)上述实验①②是探究____________对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则a为___________;乙是实验需要测量的物理量,则表格中“乙”应填写___________;上述实验②④是探究_________对化学反应速率的影响。

Ⅱ.某化学小组利用如图装置进行实验证明氧化性:KMnO4>Cl2>Br2。限选试剂:KBr溶液、KMnO4、浓盐酸、浓硫酸。
(3)装置d中观察到的现象为____________________;此实验装置的不足之处是无尾气吸收装置,请写出处理尾气的离子方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知阿伏伽德罗常数可表示为NA,则下列说法正确的是
A. 任何气体单质在标准状况下体积约为22.4L,则一定含有2NA个原子
B. 常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA
C. 常温常压下,22.4LH2O中含有的氢原子数为2NA
D. 标准状况下,0.3molCO2中含有氧原子数0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 已知图一表示的是可逆反应CO(g)+H2(g) ![]() C(s)+H2O(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)![]() N2O4(g)△H<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是( )
N2O4(g)△H<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是( )
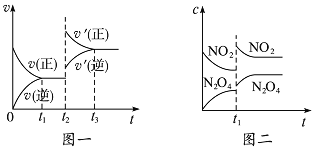
A.图一t2时改变的条件可能是升高了温度或增大了压强
B.图一t2时改变的条件是增大压强,则反应的△H增大
C.图二t1时改变的条件可能是升高了温度
D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NaHCO3溶液中存在多种平衡关系,写出相应平衡关系所对应的离子方程式:_ _ 。
NaHCO3溶液显碱性的原因: _ 。
NaHSO4溶液显酸性的原因: 。
(2)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O。放出571.6kJ的热量,表示H2燃烧热的热化学方程式为____________ 。
(3)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为______________ _ 。
(4)已知C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol,
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ/mol,
C(s)+0.5O2(g)=CO(g) △H3=akJ/mol,则a=__________
(5)已知N2(g) +3H2(g) ![]() 2NH3(g)的平衡常数为K1,0.5 N2(g)+1.5H2(g)
2NH3(g)的平衡常数为K1,0.5 N2(g)+1.5H2(g) ![]() NH3(g) 的平衡常数为K2,NH3(g)
NH3(g) 的平衡常数为K2,NH3(g) ![]() 0.5 N2(g)+1.5H2(g) 的平衡常数为K3,写出K1和K2的关系式__________,写出K2和K3的关系式____________,写出K1和K3的关系式_____________
0.5 N2(g)+1.5H2(g) 的平衡常数为K3,写出K1和K2的关系式__________,写出K2和K3的关系式____________,写出K1和K3的关系式_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com