
【题目】(1)NaHCO3溶液中存在多种平衡关系,写出相应平衡关系所对应的离子方程式:_ _ 。
NaHCO3溶液显碱性的原因: _ 。
NaHSO4溶液显酸性的原因: 。
(2)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O。放出571.6kJ的热量,表示H2燃烧热的热化学方程式为____________ 。
(3)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为______________ _ 。
(4)已知C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol,
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ/mol,
C(s)+0.5O2(g)=CO(g) △H3=akJ/mol,则a=__________
(5)已知N2(g) +3H2(g) ![]() 2NH3(g)的平衡常数为K1,0.5 N2(g)+1.5H2(g)
2NH3(g)的平衡常数为K1,0.5 N2(g)+1.5H2(g) ![]() NH3(g) 的平衡常数为K2,NH3(g)
NH3(g) 的平衡常数为K2,NH3(g) ![]() 0.5 N2(g)+1.5H2(g) 的平衡常数为K3,写出K1和K2的关系式__________,写出K2和K3的关系式____________,写出K1和K3的关系式_____________
0.5 N2(g)+1.5H2(g) 的平衡常数为K3,写出K1和K2的关系式__________,写出K2和K3的关系式____________,写出K1和K3的关系式_____________
【答案】(1)H2O ![]() H++OH-;HCO3-+H2O
H++OH-;HCO3-+H2O ![]() OH-+H2CO3;HCO3-+H2O
OH-+H2CO3;HCO3-+H2O ![]() H3O++ CO32-;NaHCO3溶液中HCO3-的水解程度大于电离程度,使得溶液中c(OH-) 大于 c(H+)而显碱性;NaHSO4溶液中NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显酸性;
H3O++ CO32-;NaHCO3溶液中HCO3-的水解程度大于电离程度,使得溶液中c(OH-) 大于 c(H+)而显碱性;NaHSO4溶液中NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显酸性;
(2)H2(g)+![]() O2(g)=H2O(l)△H=-285.8KJ/mol;
O2(g)=H2O(l)△H=-285.8KJ/mol;
(3)NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(4)-110.5;
(5)K1=K22;K2· K3=1;K1· K32=1;
【解析】
试题分析:(1)NaHCO3溶液中存在水的电离,碳酸氢钠的电离和水解,对应的离子方程式为H2O ![]() H++OH-;HCO3-+H2O
H++OH-;HCO3-+H2O ![]() OH-+H2CO3;HCO3-+H2O
OH-+H2CO3;HCO3-+H2O ![]() H3O++ CO32-;NaHCO3的电离程度小于水解程度,导致溶液显碱性;硫酸是强酸,NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显酸性,故答案为:H2O
H3O++ CO32-;NaHCO3的电离程度小于水解程度,导致溶液显碱性;硫酸是强酸,NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显酸性,故答案为:H2O ![]() H++OH-;HCO3-+H2O
H++OH-;HCO3-+H2O ![]() OH-+H2CO3;HCO3-+H2O
OH-+H2CO3;HCO3-+H2O ![]() H3O++ CO32-;NaHCO3溶液中HCO3-的水解程度大于电离程度,使得溶液中c(OH-) 大于 c(H+)而显碱性;NaHSO4溶液中NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显酸性;
H3O++ CO32-;NaHCO3溶液中HCO3-的水解程度大于电离程度,使得溶液中c(OH-) 大于 c(H+)而显碱性;NaHSO4溶液中NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显酸性;
(2)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,即2mol氢气完全燃烧放出571.6kJ的热量,则1mol氢气完全燃烧放出的燃量为285.8KJ,所以氢气的燃烧热为-285.8KJ/mol,氢气和氧气都是气态,水是液态,则氢气的燃烧热的热化学方程式为:H2(g)+![]() O2(g)=H2O(l)△H=-285.8KJ/mol;故答案为:H2(g)+
O2(g)=H2O(l)△H=-285.8KJ/mol;故答案为:H2(g)+![]() O2(g)=H2O(l)△H=-285.8KJ/mol;
O2(g)=H2O(l)△H=-285.8KJ/mol;
(3)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,中和热为-57.3kJ/mol,则中和热的热化学方程式:NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,故答案为:NaOH(aq)+
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,故答案为:NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(4)已知①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol,②2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ/mol,根据盖斯定律,将①-②×![]() 得:C(s)+0.5O2(g)=CO(g) △H3=(-393.5kJ/mol)-(-566.0kJ/mol)×
得:C(s)+0.5O2(g)=CO(g) △H3=(-393.5kJ/mol)-(-566.0kJ/mol)×![]() =-110.5kJ/mol,故答案为:-110.5;
=-110.5kJ/mol,故答案为:-110.5;
(5)0.5 N2(g)+1.5H2(g) ![]() NH3(g) 的平衡常数为K2,则 N2(g)+3H2(g)
NH3(g) 的平衡常数为K2,则 N2(g)+3H2(g) ![]() 2 NH3(g) 的平衡常数为K22,因此K1=K22;反应0.5 N2(g)+1.5H2(g)
2 NH3(g) 的平衡常数为K22,因此K1=K22;反应0.5 N2(g)+1.5H2(g) ![]() NH3(g)是NH3(g)
NH3(g)是NH3(g) ![]() 0.5 N2(g)+1.5H2(g)的逆反应,因此K2· K3=1,则K22· K32=1,因此K1· K32=1,故答案为:K1=K22;K2· K3=1;K1· K32=1;
0.5 N2(g)+1.5H2(g)的逆反应,因此K2· K3=1,则K22· K32=1,因此K1· K32=1,故答案为:K1=K22;K2· K3=1;K1· K32=1;


科目:高中化学 来源: 题型:
【题目】新型NaBH4/H2O2燃料电他(DBFC)的结构如下图.该电池总反应方程式:NaBH4+4H2O2=NaBO2+6H2O,有关的说法正确是( )
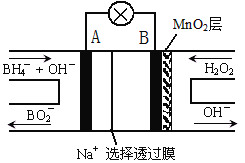
A.电池正极区的电极反应为:BH4-+8OH--8e-=BO2-+6H2O
B.电极B为负极,纳米MnO2层的作用是提离原电池的工作效率
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(有机化学基础)胡椒乙酸是合成许多药用生物碱的重要中间体,以苯酚为原料制备胡椒乙酸的合成路线如图所示。
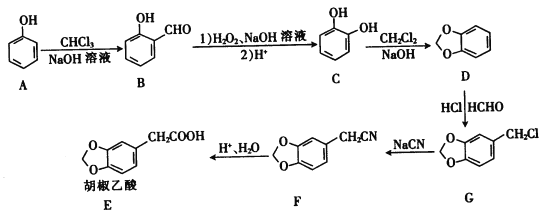
回答下列问题:
(1)下列关于有机物B的说法正确的是________(填字母)。
a.能与FeCl3溶液发生显色反应
b.核磁共振氢谱中只有3组峰
c.能发生银镜反应
d.能与溴水发生加成反应
(2)C的名称是__________,C→D的反应类型是__________。
(3)胡椒乙酸(E)中所含官能团的名称为______________。
(4)G生成F的化学方程式为____________。
(5)W是E的同分异构体,0.5molW与足量碳酸氢钠溶液反应生成1molCO2,已知W的苯环上只有2个取代基,则W的结构共有___________(不含立体异构)种,其中核磁共振氢谱有五组峰的结构简式为____________。
(6)参照上述合成路线,写出以一氯甲苯(![]() )为原料(无杌试剂任选)制备苯乙酸的合成路线:______________________。
)为原料(无杌试剂任选)制备苯乙酸的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应:2A(g)+3B(g)![]() xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
A. 2min末时A和B的浓度之比为5:3
B. x=1
C. 2min末时B的浓度为1.5mol/L
D. 2min末时A的消耗浓度为0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)及其化合物可用于制半导体及除草剂等。回答下列问题:
(1)砷是氮的同族元素,比氮多2个电子层,砷在周期表中的位置为第__________周期___________族;AsH3的热稳定性比NH3___________(填“强”或“弱”)。砷在自然界中丰度最大的核素的中子数为40,该核素为______________(用元素符号表示)。
(2)砷化镓是常见的半导体材料,Ga与As同周期,镓最外层有3个电子,砷化镓的化学式为____________。
(3)某工业废水中含有少量的As2O3,向该废水中通入硫化氢可将其转化为更难溶的As2S3,该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
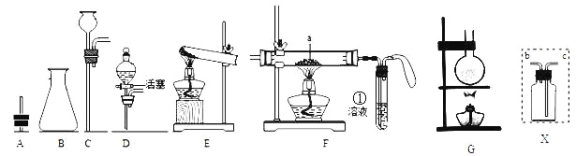
(1)用上图仪器组装成气体发生装置:制取O2可选的装置是______________。
(2)若用装置X收集制取的O2,瓶中装满水,氧气应从_____________端通入。
(3)若用F装置进行CO还原CuO的实验,实验室制取CO的方法可采取甲酸脱水法(HCOOH![]() CO↑+H2O),用纯净的CO完成该实验。
CO↑+H2O),用纯净的CO完成该实验。
I.除F、X外还需要的装置有______________,X中应加入的试剂是_________。
II.实验时①处选择的溶液可以为_______,其作用是_____________;F装置中气球的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 石墨和C60互为同位素
B. CH4和CH3CH3互为同系物
C. 14CO2的摩尔质量为46
D. 3517Cl、3717Cl 为不同的核素,有不同的化学性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)![]() xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
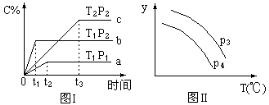
A.P3>P4,y轴表示B的转化率
B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的密度
D.P3<P4,y轴表示混合气体的平均摩尔质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com