
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
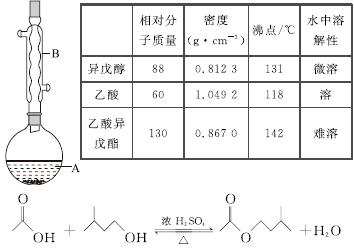
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是________________。
(2)在洗涤操作中,第一次水洗的主要目的是____________________________________,第二次水洗的主要目的是________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是___________________________________________。
(5)实验中加入少量无水MgSO4的目的是________。
(6)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
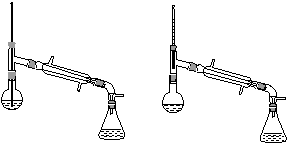
a. b.
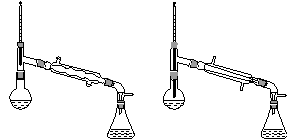
c. d.
(7)本实验的产率是________(填标号)。
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏__________(填“高”或“低”),其原因是______________________________。
(1)球形冷凝管 (2)洗掉大部分硫酸和醋酸 洗掉碳酸氢钠 (3)d (4)提高醇的转化率 (5)干燥 (6)b (7)c (8)高 会收集少量未反应的异戊醇
[解析] (2)第一次水洗是除去作催化剂的硫酸和过量的醋酸,然后用饱和NaHCO3溶液进一步除去少量乙酸,第二次水洗是为了除去过量饱和NaHCO3溶液。(3)洗涤、分液后有机层在上面,水层在下面,需将水层从分液漏斗下口放出,再将有机层从分液漏斗上口倒出,d项正确。(4)题中所给反应为可逆反应,加入过量的乙酸,能提高异戊醇的转化率和提高乙酸异戊酯的产率。(5)加少量的无水MgSO4能除去有机层中的少量水,起到干燥作用。(6)蒸馏时温度计水银球末端需和蒸馏烧瓶支管口在同一高度,即b正确。(7)根据题中数据可求出乙酸异戊酯的理论产量为6.5 g,而实际生成乙酸异戊酯3.9 g,其产率为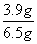 ×100%=60%。(8)若从130 ℃开始收集馏分,收集得到乙酸异戊酯和少量未反应的异戊醇,使测得实验产率偏高。
×100%=60%。(8)若从130 ℃开始收集馏分,收集得到乙酸异戊酯和少量未反应的异戊醇,使测得实验产率偏高。


科目:高中化学 来源: 题型:
下列变化需要吸收能量的是
A.1s22s22p63s1→1s22s22p6 B.3s23p5→3s23p6
C.2p2x2p1y2p1z→2p1x2p1y2p2z D.2H→H—H
查看答案和解析>>
科目:高中化学 来源: 题型:
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( )
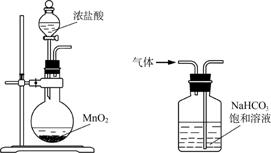
甲 乙
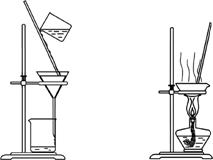
丙 丁
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 炭粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |

(2)编号①实验测得容器中的压强随时间的变化如图(a)所示。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图(b)中用箭头标出发生该腐蚀时电子的流动方向;此时,炭粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是__________。
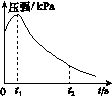

(a) (b)
(3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。

查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
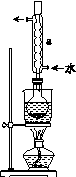
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s)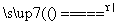 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是____________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________________________________________________________________________
________________________________________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O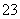 +I2===S4O
+I2===S4O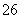 +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
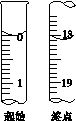
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO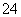 ,常用作脱氯剂,该反应的离子方程式为____________________________________________。
,常用作脱氯剂,该反应的离子方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列叙述中正确的是 ( )
A.标准状况下,2.24 L苯中约含有个NA碳原子
B.标准状况下,22.4 L H2中含中子数为2NA
C.1 L 1 mol/L醋酸溶液中离子总数为2NA
D.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程没有发生化学反应的是
A.用活性炭去除冰箱中的异味
B.用热碱水清除炊具上残留的油污
C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
D.用含硅胶、铁粉的透气小袋与食品一起密封包装
查看答案和解析>>
科目:高中化学 来源: 题型:
世界卫生组织(WHO)将ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。ClO2属于( )。
A.氧化物 B.酸 C.碱 D.盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com