
下列过程没有发生化学反应的是
A.用活性炭去除冰箱中的异味
B.用热碱水清除炊具上残留的油污
C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
D.用含硅胶、铁粉的透气小袋与食品一起密封包装
【知识点】物理变化与化学变化的区别与联系
【答案解析】A 解析:A、活性炭具有较大的表面积,能够吸附冰箱中的异味,该过程没有新物质的生成,属于物理变化,故A正确;B、油污的成分是油脂,在碱性条件下发生水解生成易溶于水的高级脂肪酸钠和甘油,该过程有新物质生成,属于化学变化,故B错误;C、乙烯具有催熟作用,为了延长水果的保鲜期,用高锰酸钾可以除掉乙烯,该过程中乙烯与高锰酸钾反应氧化还原反应,故C错误;D、硅胶具有吸收性,可以做干燥剂,吸收水分,属于物理变化;铁粉具有还原性,防止食物被氧化,发生氧化还原反应,属于化学变化,故D错误;
故答案选A
【思路点拨】本题考查了化学变化与物理变化的区别,判断依据是:是否有新物质的生成,题目难度不大,该题各个选项与现实生活接触紧密,比较新颖,注意相关知识的积累。


科目:高中化学 来源: 题型:
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
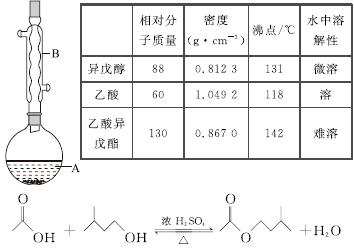
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是________________。
(2)在洗涤操作中,第一次水洗的主要目的是____________________________________,第二次水洗的主要目的是________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是___________________________________________。
(5)实验中加入少量无水MgSO4的目的是________。
(6)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
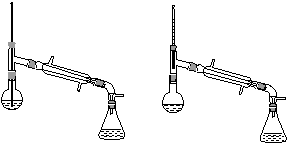
a. b.
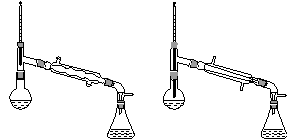
c. d.
(7)本实验的产率是________(填标号)。
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏__________(填“高”或“低”),其原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:

实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是________________。
(2)在洗涤操作中,第一次水洗的主要目的是____________________________________,第二次水洗的主要目的是________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是___________________________________________。
(5)实验中加入少量无水MgSO4的目的是________。
(6)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
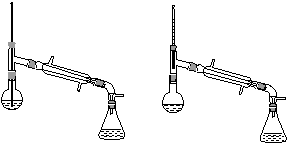
a. b.

c. d.
(7)本实验的产率是________(填标号)。
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏__________(填“高”或“低”),其原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对各组离子或物质是否能够大量共存解释正确的是 ( )
| A | 常温常压下NH3、O2、H2、CO2 | 不能共存 | NH3为碱性气体,CO2为酸性气体,二者反应生成(NH4)2CO3 |
| B | C(OH-)=1X10-13mol/l溶液中,Fe2+、NO3-、SO42-、Na+ | 不能共存 | 发生反应3Fe2++NO3-+4H+=3Fe3++NO+2H2O |
| C | 溶液中: K+、Cu2+、Cl-、NH3•H2O | 不能共存 | 发生反应Cu2++2OH-=Cu(OH)2 |
| D | 溶液中Al3+、Na+、SO42-、HCO3- | 可以共存 | 不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在T℃时,将ag NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为W,其中含NH4+的物质的量为bmol。下列叙述中正确的是 ( )
A.溶质的质量分数为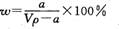
B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于O.5w
C.溶液中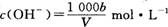
D.溶质的物质的量浓度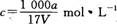
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要O.1 mol/L NaOH溶液450 mL和0.5mol/l硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
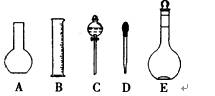
(1)如图所示的仪器中配制溶液需要的是 (填字号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)下列操作中,是容量瓶所具备的功能有 。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.配制任意浓度和体积的标准溶液
D.稀释某一浓度的溶液
E.量取一定体积的液体
(3)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度 (填“大于”“等于”或“小于”)O.1 mol/l。若NaOH溶液在转移至容量瓶时,洒落了少许,则需要如何操作: 。(4)根据计算得知,所需质量分数为98%、密度为l.84 g/cm3的浓硫酸的体积为 ml。如果实验室有10 mL,15 mL,20 mL量筒,应选用 mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是
(5)下列操作会使配制的NaOH溶液浓度偏低 的是。
A.用滤纸称量NaOH
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的有几句( )
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化
A.4 B.3 C.2 D.1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列各组反应的反应物及温度,则反应开始时,放出H2的速率最快的是(表中
的物质均为反应物)
| 编号 | 金属(大小、形状相同的粉末)物质的量 | 酸的浓度及体积 | 反应温度/℃ |
| A | Mg 0.1 mol | 3 mol/L的硝酸10 mL | 60 |
| B | Mg 0.1 mol | 3 mol/L的盐酸10 mL | 30 |
| C | Fe 0.1 mol | 3 mol/L的盐酸10 mL | 60 |
| D | Mg 0.1 mol | 3 mol/L的盐酸10 mL | 60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
研究性学习小组进行SO2的制备及性质探究实验。
⑴ 根据反应Na2SO3(固) + H2SO4(浓) == Na2SO4 + SO2↑+H2O,制备SO2气体。
用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
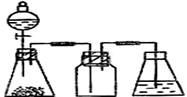
② 实验过程中,使用分液漏斗滴加浓硫酸的操作是__________________________。
⑵ 将SO2气体分别通入下列溶液中:
① 品红溶液,现象是__________________________________________________。
② 溴水溶液,现象是_________________________________________________。
③ 硫化钠溶液,现象是________________________________________________。
⑶ 有一小组在实验中发现,SO2氧化产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)
① 原因_______________________,验证方法________________________________。
② 原因_______________________,验证方法________________________________。
③ 原因_______________________,验证方法________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com