
下列对各组离子或物质是否能够大量共存解释正确的是 ( )
| A | 常温常压下NH3、O2、H2、CO2 | 不能共存 | NH3为碱性气体,CO2为酸性气体,二者反应生成(NH4)2CO3 |
| B | C(OH-)=1X10-13mol/l溶液中,Fe2+、NO3-、SO42-、Na+ | 不能共存 | 发生反应3Fe2++NO3-+4H+=3Fe3++NO+2H2O |
| C | 溶液中: K+、Cu2+、Cl-、NH3•H2O | 不能共存 | 发生反应Cu2++2OH-=Cu(OH)2 |
| D | 溶液中Al3+、Na+、SO42-、HCO3- | 可以共存 | 不能发生反应 |
【知识点】离子大量共存问题
【答案解析】B 解析:A、干燥的氨气与二氧化碳不发生反应,常温下NH3、O2、H2、CO2能够共存,故A错误;B、c(OH-)=1.0×10-13mol/L溶液为酸性溶液,硝酸根离子在酸性条件下能够与亚铁离子发生氧化还原反应,溶液中不能够大量共存,故B正确;C、铜离子与氨水反应的离子方程式为:Cu2++4NH3•H2O═Cu(NH3)42++4H2O,故C错误;D、铝离子与碳酸氢根离子发生反应:Al3++3HCO3-═Al(OH)3+3CO2↑,故D错误;
故答案选B
【思路点拨】本题考查了离子共存的判断,注意熟练掌握离子反应发生的条件:生成气体、难溶物、沉淀及发生氧化还原反应,题目难度中等。


科目:高中化学 来源: 题型:
“神七”火箭使用的燃料仍是偏二甲肼,其结构可以看作是两个甲基和一个氨基(—NH2)替代了氨气分子中的三个氢原子,下列关于偏二甲肼的说法不正确的是
A.由碳、氢、氮三种元素组成 B.所有N、C原子都在同一平面上
C.分子中所有的N原子均是sp3杂化 D.分子式为C2H8N2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( )
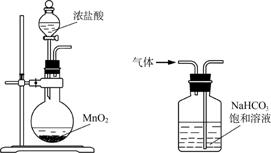
甲 乙
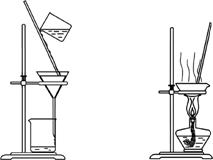
丙 丁
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
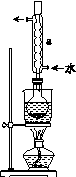
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s)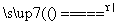 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是____________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________________________________________________________________________
________________________________________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O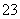 +I2===S4O
+I2===S4O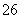 +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
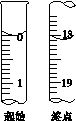
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO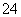 ,常用作脱氯剂,该反应的离子方程式为____________________________________________。
,常用作脱氯剂,该反应的离子方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列叙述中正确的是 ( )
A.标准状况下,2.24 L苯中约含有个NA碳原子
B.标准状况下,22.4 L H2中含中子数为2NA
C.1 L 1 mol/L醋酸溶液中离子总数为2NA
D.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各选项中的两个反应,可用同一个离子方程式表示的是 ( )
| 选项 | Ⅰ | Ⅱ |
| A | Ba(OH)2溶液与过量NaHCO3溶液混合 | NaOH溶液与过量NaHCO3溶液混合 |
| B | 少量SO2通入Ba(OH)2溶液中 | 过量SO2通入Ba(OH)2溶液中 |
| C | BaCl2溶液与Na2SO3溶液混合 | Ba(OH)2溶液与H2SO3溶液混合 |
| D | 少量氨水滴入AlCl3溶液中 | 少量AlCl3溶液滴入氨水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程没有发生化学反应的是
A.用活性炭去除冰箱中的异味
B.用热碱水清除炊具上残留的油污
C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
D.用含硅胶、铁粉的透气小袋与食品一起密封包装
查看答案和解析>>
科目:高中化学 来源: 题型:
铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 。
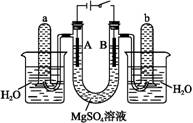
(2)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是 。
②通电开始后,阴极附近溶液pH会增大,请简述原因 。
③除去杂质后的氢氧化钾溶液从溶液出口 (填写“A”或“B”)导出。
(3)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s) 6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
CaO(s)+SiO2(s) CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s) 6CaSiO3(s)+P4(s)+10CO(g) ΔH3
6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3= kJ·mol-1。
 (4)焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
(4)焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g) H2O(l) ΔH2=-44 kJ·mol-1;
H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O (g) 2H2SO4(l) ΔH3=-545 kJ·mol-1。
2H2SO4(l) ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组溶液,不用其他试剂,就能将组内物质鉴别出来的是( )。
A.CuSO4 NaOH BaCl2 HCl B.NaCl HCl H2SO4 AgNO3
C.KCl HCl NaOH BaCl2 D.NaOH KOH MgCl2 H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com