
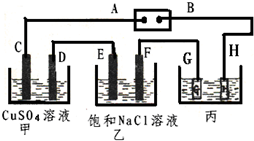
 如图所示的装置,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液.在F极附近显红色.试回答以下问题:
如图所示的装置,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液.在F极附近显红色.试回答以下问题:
| ||
| 5.6 |
| 22.4 |
| 0.5 |
| 50 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、 用于放出碘的四氯化碳溶液 |
B、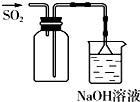 用于实验室收集SO2 |
C、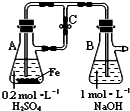 用于实验室制备Fe(OH)2 |
D、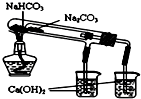 用于比较NaHCO3和Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④⑤ | B、②④⑤ |
| C、①②④⑤ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉是纯净物,漂白液是混合物 |
| B、漂白粉的有效成分是Ca(ClO)2 |
| C、工业上将氯气通入澄清石灰水制取漂白粉 |
| D、漂白液的有效成分是Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B、0.1mol?L-1 NH4Cl溶液中:c(NH4+)+c(NH3?H2O)=c(Cl-) |
| C、0.1mol?L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、等体积、等物质的量浓度的CH3COONa和弱酸CH3COOH混合后的溶液中:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑥⑦ | B、②③⑤⑦ |
| C、①③④⑤ | D、全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com