
| A、②③④⑤ | B、②④⑤ |
| C、①②④⑤ | D、③④⑤ |


科目:高中化学 来源: 题型:
| A、O2和O3 |
| B、16O和18O |
| C、CH3CH2OH和CH3OCH3 |
| D、CH3CH2CH3和CH3(CH2)2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
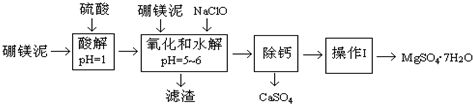
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
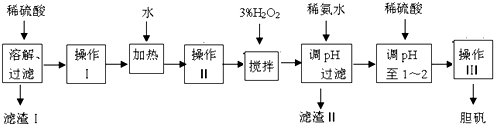
| Fe3+ | Fe2+ | Cu2+ | |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H6,C3H6 C4H6 |
| B、CH4,C2H4,C3H4 |
| C、CH4,C2H6,C3H8 |
| D、C2H4,C2H2,CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
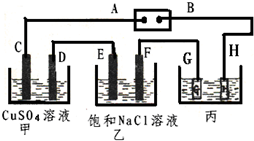 如图所示的装置,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液.在F极附近显红色.试回答以下问题:
如图所示的装置,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液.在F极附近显红色.试回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、1:1 |
| C、1:2 | D、2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com