
| Fe3+ | Fe2+ | Cu2+ | |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | x |
|
| 1×10-14 |
| 4×10-8 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
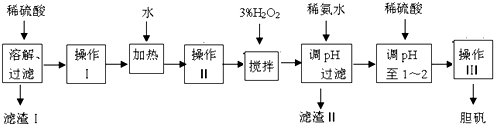
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
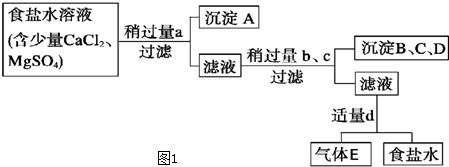
科目:高中化学 来源: 题型:
A、 用于放出碘的四氯化碳溶液 |
B、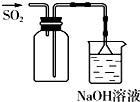 用于实验室收集SO2 |
C、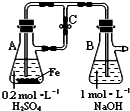 用于实验室制备Fe(OH)2 |
D、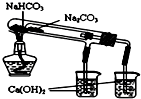 用于比较NaHCO3和Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤(不要写出具体的操作过程,试剂任选) | 预期的实验现象 | 实验结论 |
| 步骤1: 步骤2: 步骤3: | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
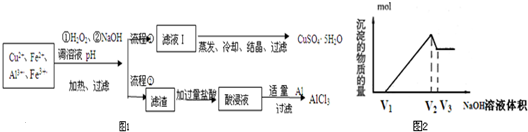
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、②③④ |
| C、③⑤⑥ | D、②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④⑤ | B、②④⑤ |
| C、①②④⑤ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉是纯净物,漂白液是混合物 |
| B、漂白粉的有效成分是Ca(ClO)2 |
| C、工业上将氯气通入澄清石灰水制取漂白粉 |
| D、漂白液的有效成分是Na2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com