
| 1000ρω |
| M |
| n |
| V |
| 1000ρω |
| M |
| 1000×1.06g/ml×ω |
| 40g/mol |


科目:高中化学 来源: 题型:
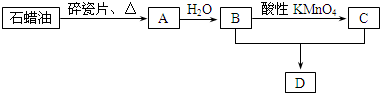
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、H+、Cl-、HCO3- |
| B、Mg2+、Al3+、Cl-、SO42- |
| C、Na+、H+、NO3-、OH- |
| D、NH4+、Ag+、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
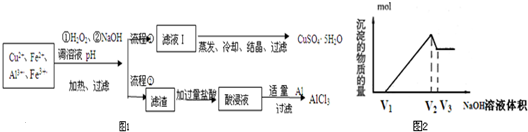
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④⑤ | B、②④⑤ |
| C、①②④⑤ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
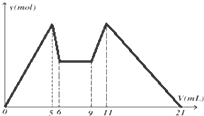 如图是向MgCl2、AlCl3混合溶液中,先后加入试剂A、B时所得沉淀物质的量y(mol) 与试剂体积V(mL)间的关系图.开始滴加6mL试剂A后继续滴加A若干,之后改滴试剂B.以下结论正确的是( )
如图是向MgCl2、AlCl3混合溶液中,先后加入试剂A、B时所得沉淀物质的量y(mol) 与试剂体积V(mL)间的关系图.开始滴加6mL试剂A后继续滴加A若干,之后改滴试剂B.以下结论正确的是( )| A、可能是NaOH,B可能是盐酸,且2C(A)=C(B) |
| B、若A和B均为一元强酸或一元强碱,则滴加7mL试剂A后改滴试剂B |
| C、A可能是Ba(OH)2,B可能是硫酸,且C(A)=C(B) |
| D、原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:2:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B、0.1mol?L-1 NH4Cl溶液中:c(NH4+)+c(NH3?H2O)=c(Cl-) |
| C、0.1mol?L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、等体积、等物质的量浓度的CH3COONa和弱酸CH3COOH混合后的溶液中:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、SCN-、Na+、Cl- |
| B、Cl-、AlO2-、HCO3-、Na+ |
| C、Fe2+、NH4+、SO42-、S2- |
| D、Ca2+、HCO3-、Cl-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com