
| A、Fe3+、SCN-、Na+、Cl- |
| B、Cl-、AlO2-、HCO3-、Na+ |
| C、Fe2+、NH4+、SO42-、S2- |
| D、Ca2+、HCO3-、Cl-、K+ |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中导电粒子的数目减少 | ||
B、溶液中
| ||
| C、醋酸的电离程度增大,c(H+)亦增大 | ||
| D、完全中和醋酸需加入10mLpH=11的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、1:1 |
| C、1:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
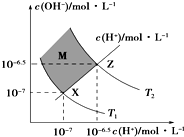
| A、两条曲线间任意点均有c(H+)×c(OH-)=KW |
| B、M区域内任意点对应的溶液均显酸性 |
| C、图中T1<T2 |
| D、XZ线上任意点均有pH=pKw/2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 |
B、基态碳原子的价电子排布图: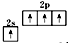 |
C、基态铜原子的价电子排布图: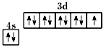 |
| D、Fe3+的最外层电子排布式为:3s23p63d5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0L 0.1 mol?L-1乙酸溶液中,H+离子与CH3COOH分子数目之和约为0.1NA |
| B、pH=2.0的HCl溶液中,水电离产生的H+离子数目为1.0×10-12NA |
| C、1.0L 0.1 mol?L-1乙酸钠溶液中,CH3COO-离子与CH3COOH分子数目之和为0.1NA |
| D、将1.0L pH=2的乙酸溶液加大量水稀释后,溶液中H+离子数目大于0.01 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com