
| A、原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 |
B、基态碳原子的价电子排布图: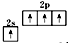 |
C、基态铜原子的价电子排布图: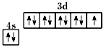 |
| D、Fe3+的最外层电子排布式为:3s23p63d5 |
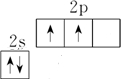 ,故B错误;
,故B错误;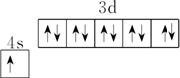 ,故C错误;
,故C错误;

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、0.1mol?L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B、0.1mol?L-1 NH4Cl溶液中:c(NH4+)+c(NH3?H2O)=c(Cl-) |
| C、0.1mol?L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、等体积、等物质的量浓度的CH3COONa和弱酸CH3COOH混合后的溶液中:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、SCN-、Na+、Cl- |
| B、Cl-、AlO2-、HCO3-、Na+ |
| C、Fe2+、NH4+、SO42-、S2- |
| D、Ca2+、HCO3-、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中性溶液的pD=7.0 |
| B、含0.01 mol的NaOH的D2O溶液1 L,其pD=12.0 |
| C、溶有0.01 mol DCl的水溶液1 L,其pD=2.0 |
| D、在100 mL 0.2 mol?L-1的DCl重水溶液中,加入100 mL 0.2 mol?L-1的NaOD的重水溶液,其pD=7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体的分散质能通过滤纸空隙,而浊液的分散质不能 |
| B、分散质粒子直径在10-9~10-7m之间 |
| C、胶体能产生丁达尔现象 |
| D、胶体是纯净物,气体分散系是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化剂仅是CuSO4,FeS2仅是还原剂 | ||
| B、当生成7molCu2S时,共转移电子14mol | ||
| C、产物中SO42-全部是氧化产物 | ||
D、该反应中1molCuSO4能氧化
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、次氯酸钙的化学式 CaClO |
| B、次氯酸的电离HClO=H++Cl-+O2- |
| C、硫酸的电离H2SO4=H2++SO42- |
D、镁的原子结构示意图: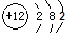 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com