
| A、氧化剂仅是CuSO4,FeS2仅是还原剂 | ||
| B、当生成7molCu2S时,共转移电子14mol | ||
| C、产物中SO42-全部是氧化产物 | ||
D、该反应中1molCuSO4能氧化
|
| 1 |
| 14 |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
| A、原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 |
B、基态碳原子的价电子排布图: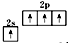 |
C、基态铜原子的价电子排布图: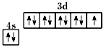 |
| D、Fe3+的最外层电子排布式为:3s23p63d5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
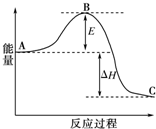 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NO2由反应N2+2O2
| ||||
B、总反应可表示为2SO2+2H2O
| ||||
| C、还可能发生的反应有4NO2+O2+2H2O═4HNO3 | ||||
| D、还可能发生的反应有4NO+3O2+2H2O═4HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1 mol任何物质的体积都约为22.4 L |
| B、1 mol任何气体所含分子数都相等,体积也都约为22.4 L |
| C、相同状况下,1 L CO一定比1 L O2的质量小 |
| D、在同温同压下,相同体积的任何气体单质所含原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0L 0.1 mol?L-1乙酸溶液中,H+离子与CH3COOH分子数目之和约为0.1NA |
| B、pH=2.0的HCl溶液中,水电离产生的H+离子数目为1.0×10-12NA |
| C、1.0L 0.1 mol?L-1乙酸钠溶液中,CH3COO-离子与CH3COOH分子数目之和为0.1NA |
| D、将1.0L pH=2的乙酸溶液加大量水稀释后,溶液中H+离子数目大于0.01 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓SO42- |
| B、H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++=BaSO4↓+H2O |
| C、铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag |
| D、澄清石灰水中加入盐酸 Ca(OH)2+2H+=Ca2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A占的体积比B大 |
| B、A的物质的量比B大 |
| C、A的密度比B小 |
| D、A的摩尔质量比B大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com