
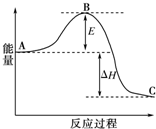
 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
| 1 |
| 2 |
| 1 |
| 2 |


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
| A、①④⑥⑦ | B、②③⑤⑦ |
| C、①③④⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中性溶液的pD=7.0 |
| B、含0.01 mol的NaOH的D2O溶液1 L,其pD=12.0 |
| C、溶有0.01 mol DCl的水溶液1 L,其pD=2.0 |
| D、在100 mL 0.2 mol?L-1的DCl重水溶液中,加入100 mL 0.2 mol?L-1的NaOD的重水溶液,其pD=7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体的分散质能通过滤纸空隙,而浊液的分散质不能 |
| B、分散质粒子直径在10-9~10-7m之间 |
| C、胶体能产生丁达尔现象 |
| D、胶体是纯净物,气体分散系是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化剂仅是CuSO4,FeS2仅是还原剂 | ||
| B、当生成7molCu2S时,共转移电子14mol | ||
| C、产物中SO42-全部是氧化产物 | ||
D、该反应中1molCuSO4能氧化
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com