
| A、x+4 | B、x+8 |
| C、x+10 | D、x+18 |


科目:高中化学 来源: 题型:
| A、2:1 | B、1:1 |
| C、1:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
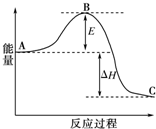 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1 mol任何物质的体积都约为22.4 L |
| B、1 mol任何气体所含分子数都相等,体积也都约为22.4 L |
| C、相同状况下,1 L CO一定比1 L O2的质量小 |
| D、在同温同压下,相同体积的任何气体单质所含原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0L 0.1 mol?L-1乙酸溶液中,H+离子与CH3COOH分子数目之和约为0.1NA |
| B、pH=2.0的HCl溶液中,水电离产生的H+离子数目为1.0×10-12NA |
| C、1.0L 0.1 mol?L-1乙酸钠溶液中,CH3COO-离子与CH3COOH分子数目之和为0.1NA |
| D、将1.0L pH=2的乙酸溶液加大量水稀释后,溶液中H+离子数目大于0.01 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都不稳定,密封静置,会产生沉淀 |
| B、都能产生丁达尔现象 |
| C、分散质微粒都可以透过滤纸 |
| D、加入盐酸先产生沉淀,随后溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓SO42- |
| B、H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++=BaSO4↓+H2O |
| C、铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag |
| D、澄清石灰水中加入盐酸 Ca(OH)2+2H+=Ca2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸的摩尔质量是98g |
| B、标准状况下,22.4L的O2质量是32g |
| C、2gH2所含原子数目为1mol |
| D、铁原子的摩尔质量等于铁的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
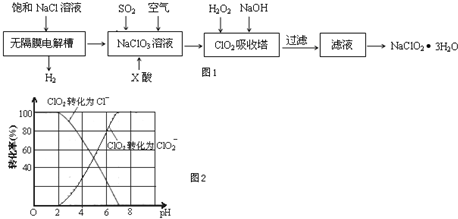
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com