
| A、中性溶液的pD=7.0 |
| B、含0.01 mol的NaOH的D2O溶液1 L,其pD=12.0 |
| C、溶有0.01 mol DCl的水溶液1 L,其pD=2.0 |
| D、在100 mL 0.2 mol?L-1的DCl重水溶液中,加入100 mL 0.2 mol?L-1的NaOD的重水溶液,其pD=7.0 |
| 1.6×10 -15 |
| 0.01 |
| 1.6×10 -15 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、1:1 |
| C、1:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
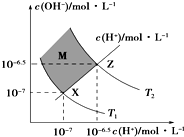
| A、两条曲线间任意点均有c(H+)×c(OH-)=KW |
| B、M区域内任意点对应的溶液均显酸性 |
| C、图中T1<T2 |
| D、XZ线上任意点均有pH=pKw/2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 |
B、基态碳原子的价电子排布图: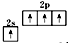 |
C、基态铜原子的价电子排布图: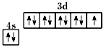 |
| D、Fe3+的最外层电子排布式为:3s23p63d5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
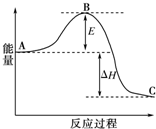 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓SO42- |
| B、H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++=BaSO4↓+H2O |
| C、铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag |
| D、澄清石灰水中加入盐酸 Ca(OH)2+2H+=Ca2++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com