
| A、KOH |
| B、H2SO4 |
| C、CH3COOH |
| D、NaCl |
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、Cl2 |
| B、SO2 |
| C、NaClO |
| D、KMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
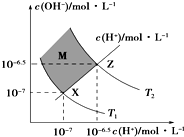
| A、两条曲线间任意点均有c(H+)×c(OH-)=KW |
| B、M区域内任意点对应的溶液均显酸性 |
| C、图中T1<T2 |
| D、XZ线上任意点均有pH=pKw/2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 |
B、基态碳原子的价电子排布图: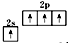 |
C、基态铜原子的价电子排布图: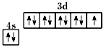 |
| D、Fe3+的最外层电子排布式为:3s23p63d5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| B、VIA族元素的氢化物中,稳定性最好的其沸点也最高 |
| C、根据某元素原子的质子数和中子数,可以确定该元素的相对原子质量 |
| D、同周期非金属氧化物对应的水化物的酸性从左到右依次增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NO2由反应N2+2O2
| ||||
B、总反应可表示为2SO2+2H2O
| ||||
| C、还可能发生的反应有4NO2+O2+2H2O═4HNO3 | ||||
| D、还可能发生的反应有4NO+3O2+2H2O═4HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中可能含有1.5mol Na2SO4和0.5molNaCl |
| B、SO42-离子和Cl-离子的物质的量之和等于Na+的物质的量 |
| C、SO42-所带的电荷数是Na+所带的电荷数的3/5倍 |
| D、Na2SO4和NaCl物质的量浓度之比为1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com