
| A. | Ba(OH)2 | B. | Ba(NO3)2 | C. | BaC12 | D. | Na2S |
分析 A.SO2和Ba(OH)2 反应生成BaSO3沉淀;
B.SO2溶于水生成H2SO3,而亚硫酸电离的H+和硝酸根组成了硝酸,能将+4的S氧化成SO42-,而形成BaSO4沉淀;
C.SO2溶于水生成的H2SO3是弱酸,不会与强酸的钡盐发生复分解反应;
D.S2-和SO2发生氧化还原反应,生成S单质沉淀.
解答 解:A.SO2为酸性氧化物,Ba(OH)2 反应生成BaSO3白色沉淀和水,故A错误;
B.SO2溶于水生成H2SO3,而亚硫酸电离的H+和硝酸根组成了硝酸,硝酸具有强氧化性,能将+4的S氧化成SO42-,而形成BaSO4白色沉淀,故B错误;
C.SO2溶于水生成的H2SO3是弱酸,因为弱酸不能制强酸,SO2不能和BaCl2发生反应,所以不会出现沉淀,故C正确;
D.S2-具有还原性,SO2具有氧化性,S2-和SO2发生氧化还原反应,生成S淡黄色沉淀,故D错误;
故选C.
点评 本题考查二氧化硫的性质,为高频考点,侧重于学生的分析能力的考查二氧化硫为酸性氧化物,溶于水生成亚硫酸、亚硫酸为多元弱酸,并且二氧化硫还具有漂白性、氧化性和还原性,解题时要认真分析.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
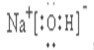 ,CB2的电子式为
,CB2的电子式为 .
.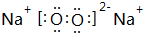 ,该物质与 CB2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.
,该物质与 CB2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能证明 | B. | 都不能证明 | C. | 只有④能证明 | D. | ③④能证明 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2有导电性,所以SiO2可用于制备光导纤维 | |
| B. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| C. | 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通CO2 | |
| D. | 由Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CO2↑+Na2SiO3可知硅酸的酸性大于碳酸的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
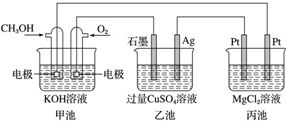
| A. | 甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置 | |
| B. | 甲池通入 CH3OH 的电极反应式为 CH3OH-6e-+2H2O═CO23-+8H+ | |
| C. | 反应一段时间后,向乙池中加入一定量 Cu(OH)2固体能使 CuSO4溶液恢复到原浓度 | |
| D. | 甲池中消耗 280 mL(标准状况下)O2,此时丙池中理论上最多产生 1.45 g 固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v ( N2)=0.2mol/(L•min) | B. | v ( N2)=0.1mol/(L•min) | ||
| C. | v ( NH3)=0.1mol/(L•min) | D. | v (H2)=0.3mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com