
【题目】氨水和铵盐是实验室常用试剂,也是重要的工业产品,
(1)实可用如图I装置制取氮气 ①用装置I中药品制取氮气的化学方程式为
②I中反应开始的一段时间反应速率越来越快,其可能原因是
(2)实驗室可利用下列装置结合装置Ⅰ模拟工业上制取氨气并检验氨气 
①装置的连接顺序为 ![]() (填玻璃接口字母)
(填玻璃接口字母)
②装置Ⅳ中用稀硫酸而不用盐酸的理由是
③能说明有氨气生成的现象是
(3)设计实验证明NH3H2O是弱电解质:(简要说明).
【答案】
(1)NaNO2+NH4Cl=NaCl+N2↑+2H2O;该反应为放热反应
(2)f,e;d,i,j,g,h,b;盐酸具有挥发性,挥发出的氯化氢与生成的氨气反应;装置Ⅱ中溶液变红色
(3)常温下,测定0.01mol/L氨水的pH值,其值小于12
【解析】解:(1)①氯化铵与亚硝酸钠发生氧化还原反应生成氮气、氯化钠和水,化学方程式:NaNO2+NH4Cl=NaCl+N2↑+2H2O; 所以答案是:NaNO2+NH4Cl=NaCl+N2↑+2H2O;②I中反应开始的一段时间反应速率越来越快,是因为该反应为放热反应,放出的热量使体系温度升高,升高温度反应速率加快;
所以答案是:该反应为放热反应;(2)①要制备制取氨气并检验氨气,装置正确顺序为Ⅰ,Ⅳ连接Ⅲ,连接Ⅵ,然后连接Ⅴ,最后连接Ⅱ,仪器连接顺序为:f,e;d,i,j,g,h,b;
所以答案是:f,e;d,i,j,g,h,b;②盐酸易挥发,制备的氢气中含有氯化氢,氯化氢能够与氨气反应,所以答案是:盐酸具有挥发性,挥发出的氯化氢与生成的氨气反应;③氨气溶于水生成一水合氨,一水合氨电离生成铵根离子与氢氧根离子,显碱性,遇到酚酞变红色,所以答案是:装置Ⅱ中酚酞溶液变红色;(3)弱电解质不能完全电离,常温下,测定0.01mol/L氨水的pH值,其值小于12即可证明一水合氨为弱电解质,
所以答案是:常温下,测定0.01mol/L氨水的pH值,其值小于12.
【考点精析】解答此题的关键在于理解氨的实验室制法的相关知识,掌握安验室制法:用铵盐与碱共热,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
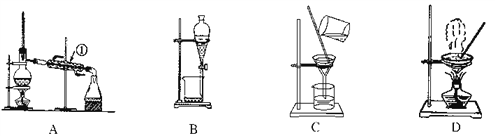
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置________。
(2)从油水混合物中分离出植物油,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从________口进水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验可行的是
A. 加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质
B. 用NaOH溶液除去CO2中混有的HCl气体
C. 将水加入到浓硫酸里进行稀释
D. 用乙醇从碘水中萃取碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:
(1)添加Cu2O的涂料或玻璃显色.
(2)制备氧化亚铜的方法之一是用铜作阳极电解NaCl和NaOH混合溶液,其原理如图所示: 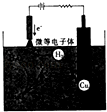
①阴极的电极反应式为 .
②溶液中CuCln1﹣n转化为Cu2O的离子方程式为
(3)工业生产中常采用高温煅烧氧化铜粉末制备Cu2O,但所得产品中会含有一定量CuO,测定产品中Cu2O的含量常用滴定法,其原理为: 样品溶解:Cu2O+Fe2(SO4)3+H2SO4═2FeSO4+2CuSO4+H2O.
滴定(未配平):□FeSO4+□KMnO4+□H2SO4═□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
①配平滴定反应的化学方程式.
②滴定时,KMnO4溶液盛放在(填“酸式”或“碱式”)滴定管中.
③若产品质量为1.0g,滴定时消耗0.10molL﹣1的KMnO4标准溶液20.00mL,则产品中Cu2O的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨水和铵盐是实验室常用试剂,也是重要的工业产品,
(1)实可用如图I装置制取氮气 ①用装置I中药品制取氮气的化学方程式为
②I中反应开始的一段时间反应速率越来越快,其可能原因是
(2)实驗室可利用下列装置结合装置Ⅰ模拟工业上制取氨气并检验氨气 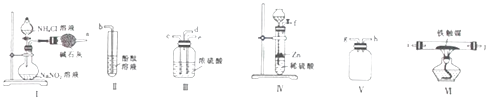
①装置的连接顺序为 ![]() (填玻璃接口字母)
(填玻璃接口字母)
②装置Ⅳ中用稀硫酸而不用盐酸的理由是
③能说明有氨气生成的现象是
(3)设计实验证明NH3H2O是弱电解质:(简要说明).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下一定能大量共存的是( )
A.在碱性溶液中:CO32﹣、K+、S2﹣、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3﹣、Mg2+、Na+、SO42﹣
C.在 ![]() ?=1×1012的溶液中:NH4+、AlO2﹣、C1﹣、K+
?=1×1012的溶液中:NH4+、AlO2﹣、C1﹣、K+
D.在中性溶液中:Fe3+、C1﹣、NO3﹣、A13+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓H2SO4(ρ=1.84g/cm3)配制250ml 0.5mol/L的稀H2SO4的操作简单可概括为计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶.请按要求填空:
(1)所需浓H2SO4的体积为 .
(2)如果实验室有10mL、20mL、50mL量筒,应选用mL量筒最好.量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将(偏高、偏低、无影响).
(3)除量筒和胶头滴管外还需用到的玻璃仪器有: .
(4)洗涤操作一般要求重复次,且洗涤液均要 .
(5)定容的操作为:向容量瓶中加入蒸馏水,至液面离刻度线处,改用胶头滴管滴加,至 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的pH=12的碱溶液甲和pH=11的碱溶液乙,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙 , 下列判断合理的是( )
A.乙一定是弱碱
B.甲一定是强碱
C.乙一定是二元碱
D.甲一定是一元碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com