
����Ŀ��Ϊ̽����ҵ���ϵ������ã�ij��ѧ��ȤС���������ͼʵ�鷽�����ú�����������ͭ�ĺϽ���ȡ�Ȼ������̷����壨FeSO47H2O���͵������壮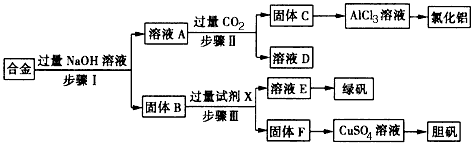
��ش�
��1��������о�����е�ʵ������� �� ʵ�����н��иò���ʱ���õ��IJ����������ձ��� ��
��2����ҺA�е���������Ҫ�����Լ�X�� ��
��3������ҺA��ͨ�����CO2�������ɹ���C�����ӷ���ʽΪ ��
��4���ӻ��������Ƕȿ��ǣ��ù���F�Ʊ�CuSO4��Һ�Ļ�ѧ����ʽ�� ��
���𰸡�
��1�����ˣ���������©��
��2��AlO ![]() ��OH����ϡ����
��OH����ϡ����
��3��AlO ![]() +CO2+H2O�T2Al��OH��3��+HCO
+CO2+H2O�T2Al��OH��3��+HCO ![]()
��4��2Cu+O2+2H2SO4 ![]() 2CuSO4+2H2O
2CuSO4+2H2O
���������⣺��������ͭ�ĺϽ���ֻ�н��������Ժ���������֮�䷴Ӧ������ҺAƫ�����ƣ�����B�ǽ������ͽ���ͭ��A��ͨ������Ķ�����̼���Եõ�������������C��̼��������ҺD�����������Ժ�����֮�䷢����Ӧ�����������������������ǽ���ͭ��ϡ����֮�䲻��Ӧ������������Һ����Ũ������ȴ�ᾧ���Ի���̷����壬����ͭ���Ի�õ������壬��1�������ӹ������������ƣ����������������Ʒ�Ӧ���������ܽ���������ƫ��������Һ���������ͽ���ͭ�����������Ʒ�Ӧ�������Ƿ����ù��ˣ��������˵õ�����Һ�ɷ�Ϊƫ�����ƣ����������ƫ��������ͨ�������Ķ�����̼����õ�����������������������Һ�е�����Ϊ̼�����ƣ������Ƿ����ù��ˣ�������н������ͽ���ͭ�����������Ʒ�Ӧ���������ᷴӦ������ͭ����Ӧ�����Ƿ����ù��ˣ������õ��IJ����������ձ�����������©���ȣ����Դ��ǣ����ˣ���������©������2�������ӹ������������ƣ�������Ӧ����ƫ�����ƺ����������ӷ���ʽΪ2Al+2OH��+2H2O=2AlO ![]() +3H2�����������ͽ���ͭ�����������Ʒ�Ӧ��������ҺA�е�������Ҫ��AlO
+3H2�����������ͽ���ͭ�����������Ʒ�Ӧ��������ҺA�е�������Ҫ��AlO ![]() ��Na+��OH�� �� ���е�������Ϊ��AlO
��Na+��OH�� �� ���е�������Ϊ��AlO ![]() ��OH������ʵ���Ŀ�����ú�����������ͭ�ĺϽ���ȡ�Ȼ������̷����壨FeSO47H2O���͵������壬�������ͽ���ͭ�����������Ʒ�Ӧ���������ᷴӦ������������������ͭ����Ӧ������ʵ�����ֽ����ķ��룬�����Լ�X��ϡ���ᣬ���Դ��ǣ�AlO
��OH������ʵ���Ŀ�����ú�����������ͭ�ĺϽ���ȡ�Ȼ������̷����壨FeSO47H2O���͵������壬�������ͽ���ͭ�����������Ʒ�Ӧ���������ᷴӦ������������������ͭ����Ӧ������ʵ�����ֽ����ķ��룬�����Լ�X��ϡ���ᣬ���Դ��ǣ�AlO ![]() ��OH����ϡ�����3����ҺA�к���ƫ�����ƣ�ƫ��������Һ��ͨ�����CO2����������������������̼�����ƣ���Ӧ�����ӷ���ʽΪ��AlO
��OH����ϡ�����3����ҺA�к���ƫ�����ƣ�ƫ��������Һ��ͨ�����CO2����������������������̼�����ƣ���Ӧ�����ӷ���ʽΪ��AlO ![]() +CO2+H2O�T2Al��OH��3��+HCO
+CO2+H2O�T2Al��OH��3��+HCO ![]() �����Դ��ǣ�AlO
�����Դ��ǣ�AlO ![]() +CO2+H2O�T2Al��OH��3��+HCO
+CO2+H2O�T2Al��OH��3��+HCO ![]() ����4����������ͼ��֪������FΪͭ��ͭ���ܺ�ϡ���ᷴӦ�����ǵ����Ȳ�ͨ�����֮��ͭ��������Ӧ��������ͭ��Ȼ������ͭ������ᷴӦ��������ͭ�����������Ⱦ���������壬����ͭ��Һ����ɫ�ģ����ڸ���Ӧ���ǻ�ϽӴ���һ��ģ���������Ӧ��ͬʱ���еģ���������ͭû���ᵥ���Ĵ��ڣ������ǿ�����Ϊ��Ӧ��Ϊ������ͭ�����ᣬ��������Ϊ����ͭ��ˮ���ʸ÷�Ӧ�Ļ�ѧ����ʽΪ��2Cu+O2+2H2SO4
����4����������ͼ��֪������FΪͭ��ͭ���ܺ�ϡ���ᷴӦ�����ǵ����Ȳ�ͨ�����֮��ͭ��������Ӧ��������ͭ��Ȼ������ͭ������ᷴӦ��������ͭ�����������Ⱦ���������壬����ͭ��Һ����ɫ�ģ����ڸ���Ӧ���ǻ�ϽӴ���һ��ģ���������Ӧ��ͬʱ���еģ���������ͭû���ᵥ���Ĵ��ڣ������ǿ�����Ϊ��Ӧ��Ϊ������ͭ�����ᣬ��������Ϊ����ͭ��ˮ���ʸ÷�Ӧ�Ļ�ѧ����ʽΪ��2Cu+O2+2H2SO4 ![]() 2CuSO4+2H2O�����Դ��ǣ�2Cu+O2+2H2SO4
2CuSO4+2H2O�����Դ��ǣ�2Cu+O2+2H2SO4 ![]() 2CuSO4+2H2O��
2CuSO4+2H2O��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ����ͬpH������һԪ��HA��HB��Һ�ֱ��ˮϡ�ͣ���ҺpH����Һ����仯��������ͼ��ʾ������˵����ȷ����(����)

A. HAһ����ǿ��
B. a����Һ�ĵ����Դ���b����Һ
C. a���c(HA)����b���c(HB)
D. HA������ǿ��HB
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̶���2L���ܱ������У�һ������SO2��1mol O2�ڴ��������¼��ȵ�600��������Ӧ��2SO2+O2![]() 2SO3����H��0������������ʵ�������0.2molʱ��Ӧ�ﵽƽ�⣬����ͬ���¶��²������ѹǿΪ��Ӧǰ��8/9�������й�������ȷ���ǣ� ��
2SO3����H��0������������ʵ�������0.2molʱ��Ӧ�ﵽƽ�⣬����ͬ���¶��²������ѹǿΪ��Ӧǰ��8/9�������й�������ȷ���ǣ� ��
A. ��SO3������������SO2�������������ʱ��Ӧ�ﵽƽ��
B. �����¶ȣ�����Ӧ���ʼ�С�̶ȱ��淴Ӧ���ʼ�С�̶ȴ�
C. ��������SO3ͨ�����BaCl2��Һ�У��õ�����������Ϊ233g
D. �ﵽƽ��ʱ��ƽ�ⳣ��Ϊ2.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β�������е�һ����Ӧ���£�NO(g)+CO(g) ![]() 1/2N2(g)+CO2(g) ��H=��373.4 kJ/mol���ں��ݵ��ܱ������У���Ӧ�ﵽƽ��ı�ijһ����������ʾ��ͼ��ȷ����( )
1/2N2(g)+CO2(g) ��H=��373.4 kJ/mol���ں��ݵ��ܱ������У���Ӧ�ﵽƽ��ı�ijһ����������ʾ��ͼ��ȷ����( )
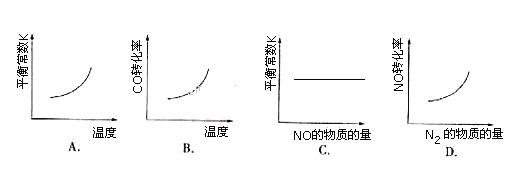
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E����Ԫ�ص�ԭ������������������A��B��C��DΪ������Ԫ�أ���ֻ��A��DΪ�ǽ���Ԫ�أ�A���⻯������ˮ�õ�����Һ��ʹ��̪��Һ��죮B��C��D������������Ӧˮ�����֮���ܹ�������Ӧ����Dԭ��������������Cԭ��������������2����B��EԪ��ͬ���壬��ԭ���������8��
��1��E��Ԫ�����ڱ��е�λ�ã� �� д��E������������Ӧˮ������C�ĵ��ʷ�Ӧ�Ļ�ѧ����ʽ�� ��
��2��A���⻯������ˮ��ĵ��뷽��ʽΪ��ʵ�����Ʊ�A���⻯��Ļ�ѧ����ʽΪ ��
��3��B�����ڿ�����ȼ�պ�IJ���Ϊ �� �����д��ڵĻ�ѧ�������� �� д���ò����ˮ��Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£��赥�ʺ�HCl��Ӧ����SiHCl3�Ǵֹ��ᴿ����Ҫ���裮ijС�������ͼ��ʾװ���������ת�����г�װ����ȥ���� 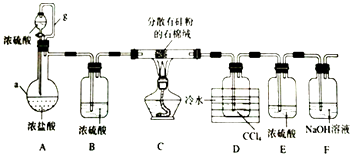
��֪��SiHCl3�ķе�Ϊ33.0��C���������л��ܼ�������ˮ���ҷ�Ӧ���ڿ������ױ�������CCl4�ķе�Ϊ76.8��C��
��ش�
��1������a������������g��������
��2��װ��A�У�Ũ�������ֵ�����Ϊ��ʵ��ʱ�����ȴ�Һ©��������һ��ʱ����ڵ�ȼC���ƾ��ƣ���������
��3��װ��C�з�����Ӧ�Ļ�ѧ����ʽΪ��
��4��װ��D�����õ�Һ̬�����ķ��뷽��Ϊ �� ����������ƣ�
��5����Ӧ�������ͨ��װ��F�е�NaOH��Һ���ݳ�����Ĵ�������Ϊ��
��6��SiHCl3�ڳ�ʪ�Ŀ����б�����������һ���������һ�������ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�־ֲ����������������Ĥ������ȵ���ʹ��һ���Ƴ������˨��ʹ�ã����Ĺ�ҵ�ϳ���������ʾ������;����;�����ѱ�����̭������ʹ�ý϶����;������

��֪���ٵ����������м�ʱ�������������������Ҫ����������λ���λ���������������Ȼ�ʱ�������������������Ҫ�������ļ�λ��
�ڱ�����![]() �������еİ����ױ�������
�������еİ����ױ�������
��ش��������⣺
��1��������B�Ľṹ��ʽΪ________��
��2����Ӧ�ߵĻ�ѧ����ʽΪ______________________________________________��
��3�����й��������ϳ�·�ߵ�˵����ȷ����________��
a����Ӧ�ٳ�����Ҫ����A�����⣬���������� �ȣ�
�ȣ�
b��;�����еIJ���ٺ͢ݿ��Ի�����
c����Ӧ�۵���һ������H2O��
d����;������ȣ�;������ȱ���Dz���࣬���ʵͣ�
e��;�����еIJ���۵�Ŀ���DZ�����������������е�KMnO4������Һ������
��4��;�����еIJ���ݺ͢��ܻ�����________��������_______________________��
��5�����������ж���ͬ���칹�壬������2����λȡ��������NH2ֱ�����ڱ����ϣ����ӽṹ�к���������ͬ���칹���У�
 ��________��________��
��________��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ʲ����������Ʊ��Ρ����̲����ǵ�ȼ���������һ����Ч���ʲ�������һ�������¿�ת��Ϊ�ʲݴ��ᡣ�����й�˵����ȷ����

A. �ʲ�����ת��Ϊ�ʲݴ�����������ˮ��
B. ��Ni�������£�1mol �ʲݴ����������3molH2�����ӳɷ�Ӧ
C. �ʲ������к����Ȼ����ʻ���̼̼˫�������ǻ��ȹ�����
D. �ʲ����ء��ʲݴ��������Na2CO3����ˮ�����Լ�������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��C��H��O����Ԫ�ص�δ֪��X,��ʵ��ⶨ��������Ԫ�ص���������Ϊ̼72.0%����6.67%�������X����Է�������Ϊ150�����й���X��˵����ȷ����
A. ʵ��ʽ�ͷ���ʽ��ΪC9H10O
B. �����ܺ��б���
C. 1 mol X��ȫȼ�գ�������5 molˮ
D. ��δ���X����Է���������Ҳ��ȷ��X�ķ���ʽ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com