
 ��h���Ƕ��Ե缫��A��ʢ��100mlCuSO4��Һ��B��ʢ��100g��������Ϊ16%������������Һ������Դ��ͨ����g�������Ժ�ɫ��
��h���Ƕ��Ե缫��A��ʢ��100mlCuSO4��Һ��B��ʢ��100g��������Ϊ16%������������Һ������Դ��ͨ����g�������Ժ�ɫ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
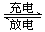 NiOOH + MH������������ȷ���ǣ� ��
NiOOH + MH������������ȷ���ǣ� ��| A���ŵ�ʱ����������Һ�ļ�����ǿ |
| B���ŵ�ʱ������ӦΪ��M + H2O + e���� MH + OH�� |
| C�����ʱ������ӦΪ��NiOOH + H2O + e���� Ni(OH)2 + OH�� |
| D���ŵ�ʱÿת��1mol���ӣ�������1mol NiOOH������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���������¼ܻ�����������һ�����ϲ� | B�������г���Ȧ����һ������� |
| C������բ����ֱ����Դ�������� | D������դ������Ϳ��һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
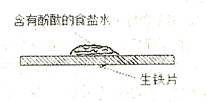
| A��ʳ��ˮ���������ݳ� |
B��������ķ�ӦΪ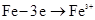 |
| C����ɫ������ʳ��ˮ�ε����ij��� |
| D����ʵ���о����ǽ�����������ʴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����������ķ�ӦΪ��Fe��2e����Fe2�� |
| B�����������ķ�ӦΪ��O2��4e��+4H+��2H2O |
| C����ʴ�����У����Ӵ��������� |
| D��������ˮ�²��ֱ��ڿ�����ˮ���紦��������������ʴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 ____��
____���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2Fe-4e ��2Fe2+ |
| B��2Fe2++4e ��2Fe |
| C��2H2O+O2+4e ��4OH�� |
| D��Fe3++e ��Fe2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

A��c��S O32����ʮc��OH����+c��HSO3����=c��Na+��+c��H+�� O32����ʮc��OH����+c��HSO3����=c��Na+��+c��H+�� |
| B��c��H2SO3��+c��HSO3����+c��SO32����=" 0.2" mol/L |
| C��c��H2SO3��+c��H+��=c��SO32����ʮc��OH-�� |
| D��c��Na+��>c��H+��>c��HSO3����>c��OH���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com